1. 1. |
Ziele des mathematisch-naturwissenschaftlichen Unterrichts "Chemie" an allgemeinbildenden Schulen |
|
| |
naturwissenschaftliches Denken
- Umsetzung von "Erkenntnis" in Erwartung und Abweichung von der Erwartung
- Erkennen der Existenz von natürlichen Gleichgewichten
Die Beschäftigung mit Chemie soll Schülerinnen und Schüler auf die naturwissenschaftliche Denkweise vorbereiten. Von Phänomenen ausgehend, sollen Beobachtungen gemacht und gesammelt werden. Durch geplante Experimente sollen die Beobachtungen systematisch untersucht werden. Die Beobachtungen werden nach Gemeinsamkeiten und Unterschieden sortiert und klassifiziert und schließlich durch Entdecken von "Regelmäßigkeiten" zu "Gesetzen" zusammengefasst. Die so gewonnenen "Naturgesetze" sollen durch Modelldenken erklärt und zu Voraussagen genutzt werden.
|
|
| |
Sicherer und sachgerechter Umgang mit Stoffen und stofflichen Änderungen
- Erkennen des Energieerhaltungssatzes für stoffliche Gleichgewichte
- Erzeugung "angeregter Stoffe" in geschlossenen Systemen
- Umgang mit "angeregten Stoffen"
- Rückführung der "angeregten Stoffe" in Stoffe der natürlichen Gleichgewichte
Schülerinnen und Schüler sollen den sicheren und sachgerechten Umgang mit Stoffen,
insbesondere Gefahrstoffen erlernen. "Chemie lehrt den verantwortungsvollen Umgang mit
Stoffen". (Umgang in Physik -> Energie; in Biologie ->Leben;
in Mathematik -> Quantifizierung).
Verantwortung übernehmen bedeutet gleichzeitig Verantwortung zu übergeben,
Voraussetzung dafür ist die Vermittlung von Kenntnissen durch eigene Erfahrung und
Tun und geschieht in Schülerübungen, wo immer es möglich und zulässig ist.
Die gesetzlichen Rahmenbedingungen der Zulässigkeit sind zusammengefasst in der
RiSU-NRW.
|
|
| |
Erlernen von verantwortlichem Handeln
- Nutzung der naturwissenschaftlichen Erkenntnis zur "Verbesserung der Lebensbedingungen" des Menschen
- Erkennen des "Verursacher-Prinzips"
- Erkennen der Bedeutung von Handeln
- Leben mit Risiko und Restrisiko
- Notwendigkeit stellvertretenden Handelns
Die technische Nutzung soll der Naturwissenschaft Chemie soll die Lebensbedingungen aller Menschen verbessern. Wenn man allein an die Versorgung mit Lebensmittel denkt, dürfte einleuchten, dass die Lebensbedingungen der Menschen nicht losgelöst sein können von den Lebensbedingungen der Tiere und Pflanzen. Die Versorgung mit Lebensmitteln für alle Menschen, deren Zahl laufend anwächst und sich daher nicht mehr im Gleichgewicht mit den natürlichen Ressourcen befindet, hat demnach auch eine nachhaltige Störung des gesamten biologischen Gleichgewichts zur Folge.
|
|
 2. 2. |
Entwicklung von naturwissenschaftlicher Erkenntnis
Es gibt kein Leben ist ohne Risiko. Risiko ist das Produkt aus Gefährdung und Eintrittswahrscheinlichkeit.
Die Flucht ist schon immer eine der Möglichkeiten gewesen, eine gefährliche Situation abzuwenden.
Eine andere Möglichkeit besteht im Versuch der absoluten Vermeidung von gefährlichen Situationen.
Die beiden folgenden Darstellungen zeigen Vermeidungsstrategien. |
|
 2.1 2.1 |
Von der Vorzeit zur Gegenwart

Bild 1: Malerei aus der Gasulla-Schlucht zum Sicherheitsgrundsatz (Bild vergrößern)
Ein Beschäftigter bei der Anwendung des Sicherheitsgrundsatzes: "Körperliche Abwesenheit ist besser als Geistesgegenwart"

Bild 2: Hauptsicherheitsingenieur zu Pferde (Bild vergrößern)
Quelle: Folien-Abbildungen aus "Sicherheit in der Chemischen Industrie" VCI;
1. Auflage; in der aktuellen Auflage fehlen diese Folien!
Der Hauptsicherheitsingenieur vermeidet alle Gefahren, nur Reiten kann er nicht mehr!
|
|
| |
Schon in der Urzeit war bekannt, "Stoffe" können nur gefährlich werden, wenn man mit ihnen in Kontakt kommt. Aber der Versuch, alle Gefahren auszuschließen, verhindert die eigentliche Absicht der "Kontaktaufnahme"!
Für den Umgang mit gefährlichen Stoffen in der Chemie bedeutet das:
Stoffe können nur miteinander reagieren, wenn sie sich berühren.
Berührungslose chemische Reaktionen sind unmöglich.
Will man chemische Reaktionen herbeiführen, so bleibt ein Restrisiko.
Diese urzeitliche Erkenntnis hat erst im 20. Jahrhundert Eingang in die Gesetzgebung gefunden.
|
|
 2.2 2.2 |
Die gesetzliche Regelung
Die Neufassung, gültig ab 1.1.2005 in der Fassung vom April 2017 finden Sie hier: http://www.baua.de 
Heute gilt das sogenannte Schutzstufen-Konzept. Die Verantwortung der Einstufung liegt beim Anwender von Chemikalien.

Bild 3: Schutzstufen (Dr. J. Häusler)
|
|
| |
Um auch hier die allmähliche Entwicklung des Sicherheitsverständnisses auf dem Wege in das Bewusstsein der Allgemeinheit aufzuzeigen, sind hier die alten Ausführungen der Gefahrstoffverordnung in Erinnerung gebracht.
Der Gesetzgeber legt für die in der Chemie vorkommenden Arbeitsverfahren in der alte Gefahrstoffverordnung (alte GefStoffV §19) die Rangfolge von Schutzmaßnahmen fest:
§19 Abs. 1 GefStoffV (alt, seit 1.1.2005 gibt es eine neue, weitgehend überarbeitete Neufassung):
"Das Arbeitsverfahren ist so zu gestalten, daß gefährliche Gase, Dämpfe oder Schwebstoffe nicht frei werden, soweit dies nach dem Stand der Technik möglich ist. Das Arbeitsverfahren ist ferner so zu gestalten, daß die Arbeitnehmer mit gefährlichen festen oder flüssigen Stoffen oder Zubereitungen nicht in Hautkontakt kommen, soweit dies nach dem Stand der Technik möglich ist. "
§19 Abs. 2 GefStoffV:
"Kann durch Maßnahmen nach Absatz 1 nicht unterbunden werden, daß gefährliche Gase, Dämpfe oder Schwebstoffe frei werden, sind diese an ihrer Austritts- oder Entstehungsstelle vollständig zu erfassen, und anschließend ohne Gefahr für Mensch und Umwelt zu entsorgen, soweit dies nach dem Stand der Technik möglich ist."
§19 Abs. 3 GefStoffV:
"Ist eine vollständige Erfassung nach Absatz 2 nicht möglich, so sind die nach dem Stand der Technik entsprechenden Lüftungsmaßnahmen zu treffen."
§19 Abs. 5 GefStoffV:
"Werden nach Durchführung der Maßnahmen nach Absatz 1 bis 3 die Maximalen Arbeitsplatzkonzentration oder der Biologische Arbeitsplatztoleranzwert nicht unterschritten, hat der Arbeitgeber
Wirksame und hinsichtlich ihrer Trageeigenschaften geeignete persönliche Schutzausrüstung zur Verfügung zu stellen und diese in gebrauchsfähigem, hygienisch einwandfreiem Zustand zu halten und
dafür zu sorgen, daß die Arbeitnehmer nur so lange beschäftigt werden, wie es mit dem Gesundheitsschutz vereinbar ist.
Satz 1 gilt auch wenn mit allergischen Reaktionen zu rechnen ist. Die Arbeitnehmer müssen die zur Verfügung gestellten persönlichen Schutzausrüstungen benutzen. Das Tragen von Atemschutz und Vollschutzanzügen darf keine ständige Maßnahme sein."
In der für die Schule zusammengestellte Vorschrift SiNTU (Sicherheit im naturwissenschaftlich-technischen Unterricht fehlte merkwürdigerweise der für die Weiterentwicklung wichtige Absatz 4 der GefStoffV:
§19 Abs. 4 GefStoffV:
"Ist die Sicherheitstechnik eines Arbeitsverfahrens fortentwickelt worden, hat sich diese bewährt und erhöht sich die Arbeitssicherheit hierdurch erheblich, so hat der Arbeitgeber das nicht entsprechende Arbeitsverfahren soweit zumutbar innerhalb einer angemessenen Frist dieser Fortentwicklung anzupassen.
Durch das Fehlen finden die zeitgemäßen "allgemeinbildenden" Unterrichtsinhalte und die Unterrichtmethoden des experimentellen Arbeiten in geschlossenen Systemen nur erschwert Eingang in den Chemie-Unterricht.
|
|
| |
Im chemischen Labor kann man drei Techniken im Bezug auf die umgesetzte Stoffportion unterscheiden. In der Makrotechnik werden Stoffportionen in der Größenordnung eines Mols umgesetzt. In der Halbmikrotechnik kommen Stoffportionen um ein Millimol zum Einsatz. Die noch kleineren Stoffportionen, um etwa ein Mikromol und darunter, zählt zur der Mikrotechnik. Sie erlaubt jedoch kaum noch ein präparatives Arbeiten, weshalb die Mikrotechnik in der Regel als Mikroanalytik bezeichnet wird.
Die Halbmikrotechnik erfüllt die Forderung nach Stoffminimierung, ohne auf die typischen Laboroperationen verzichten zu müssen. Dazu zählen insbesondere Fällungen und Filtration, Titration, Phasentrennverfahren wie Destillation und Scheiden.
Die Halbmikrotechnik nach Dr. Häusler erweitert den Schutz des Experimentierenden bis hin zur Schutzstufe 3 der Gefahrstoffverordnung - das Arbeiten in geschlossenen Systemen. Dadurch ist auch der Umgang mit besonders gefährlichen Substanzen wie giftigen Gasen möglich. Gegenüber der Makrotechnik und Mikroanalytik ist der apparative Aufwand und der Zeitfaktor für die chemischen Reaktionen hier am kleinsten.
Die Halbmikrotechnik nach Dr. Häusler wurde im Rahmen der Verleihung des 6. Gefahrstoffschutzpreises des Bundesministeriums für Wirtschaft und Arbeit besonders belobigt: Bundesanstalt für Arbeitsschutz und Arbeitsmedizin 6. Deutscher Gefahrstoffschutzpreis  ; (Poster ; (Poster  ) )
|
|
 3 3 |
Lehrauftrag und experimentelle Umsetzung
|
Natur ist Alles -Alles ist Natur.
|
|
Natur ist Alles, Alles ist Natur.
Das, was dem Mensch von der Natur erkennt ist ein Abbild seiner Sinneseindrücke und Empfindungen.
Man kann die Natur nur an bestehenden Unterschieden erkennen.
Wesentlich für das Verständnis von Natur ist die Erkenntnis, dass alle Zustände in der Natur Gleichgewichte darstellen.
Ein Gleichgewicht erkennt man daran, dass sich im betrachteten Zeitraum nichts ändert.
Um die Natur zu untersuchen, betrachtet man einen speziell abgetrennten Teil der Natur, das System. Den Rest der Natur nennt man Umgebung.
Um ein Gleichgewicht zu verändern, muss man einem System aus der Umgebung Energie zuführen oder abziehen. Es entstehen so im System wie in der Umgebung angeregte Gleichgewichte.
Überlässt man angeregte Gleichgewichte eine angemessene Zeit sich selbst, so kehren sie in das ursprüngliche Gleichgewicht zurück.
|
|
|
 3.1 3.1 |
Das anorganisch-chemische Gleichgewicht
Das anorganisch-chemische Gleichgewicht ist ein stabiles Gleichgewicht. Es gelten drei Grundgesetze für das anorganisch-chemische Gleichgewicht. Sie leiten sich ab aus den Newtonschen Axiomen der Mechanik und sind hier für die Chemie und den Stoffumsatz formuliert.
|
1.Trägheitsprinzip:
Anorganische Stoffe, die sich lange Zeit unter gleichen Bedingungen berühren, verharren in ihrem chemischen Zustand, solange keine Energie zugeführt oder entzogen wird. Dieser Zustand gilt als chemisch neutral.
|
|
2. Aktionsprinzip:
Wirkt man von außen auf Stoffe mit Energieänderung ein, so ändert sich die Temperatur, die Verteilung oder die chemische Zusammensetzung.
|
|
3. Reaktionsprinzip:
Bilden sich in einem geschlossenen System neue Stoffe, dann ist ihre chemische Wirkung qualitativ entgegengesetzt und quantitativ gleich groß.
|
|
|
| |
Diese Sätze sind nur eine allgemeinverständliche Formulierung des 2. Hauptsatzes der Thermodynamik:  , ,
wobei DH die Reaktionswärme (innere Energie) und T *DS die Verteilungsenergie bedeuten. Sie beschreiben den Energie-Erhaltungssatz als Zusammenfassung von der chemischer Energie und Verteilung. Der zweite Hauptsatz der Thermodynamik besitzt Gültigkeit für alle Stoffe und chemischen Reaktionen und beschreibt Zustand eines natürlichen Gleichgewichtes der Stoffe mit ihrer Umgebung.
|
|
 3.1.1 3.1.1 |
Herstellen von "Chemikalien" am Beispiel Marmor
Herstellen von Chemikalien aus natürlichen Stoffen durch Zufuhr von Energie - am Beispiel des Kalkbrennens
Vorwissen:
Stoffbegriff; Naturerkenntnis gewinnt man durch Beobachtung von Unterschieden; Stoffe dehnen sich beim Erwärmen aus. Zwischen Reaktionsräumen mit stark unterschiedlichen Reaktionsbedingungen gehört ein Reservevolumen. Umgang mit verdünnten Säuren und Laugen. Begriff Chemikalie, Entsorgung.
Experiment (apparativer Anteil):
|
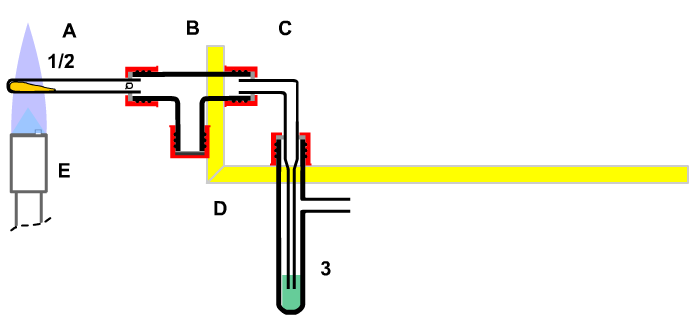
Bild 4: Apparatur zum Glühen von Marmor |
1. Apparaturteile bereitlegen und prüfen, auf dem Tisch liegend zusammenschrauben
2. Umdrehen und von hinten Federklammern und Vierkant-Stativklammern aufstecken und aufhängen;
3. Leitungswasser mit Bromthymolblau grün färben,
4. ein Drittel davon in die Gaswaschflasche geben;
5. Dichtigkeit prüfen!
(6. Flash-Animation zum Aufbau der Apparatur) |
Lernziele für das sicherheitstechnisches Denken:
- Reihenfolge beim Aufbau von Apparaturen
- Sicherheitsüberprüfung
- Blindprobe
- Umgang mit Stoffen
- Umgang mit Chemikalien
- Sinn geschlossener Apparaturen
- Recycling
|
|
 3.2 3.2 |
Das organisch-chemische Gleichgewicht
Das organisch-chemische Gleichgewicht ist gekennzeichnet durch einen energetisch angeregten Zustand. In der Natur werden diese Stoffe durch Aufwendung von Energie in Form von Licht oder Wärme gebildet. Alle organisch gebildeten Stoffe befinden sich in einem gegenüber den stabilen Endprodukten Kohlendioxid und Wasser in einem metastabilen Zustand. Der Zustand ist nur deshalb beständig, weil die weiteren Reaktionen, die zu einem stabilen Gleichgewicht führen, gehemmt sind. Anorganisch-chemische Stoffe bilden die Grundlage für "Leben".
Leben bedeutet Stoffwechsel und Nachkommenschaft und Evolution. Um den Zustand "Leben" aufrecht zu erhalten, ist dazu ein dauernder Austausch von Stoffen und Energie mit der Umgebung notwendig. Wenn Gleichgewichte die Natur prägen, so müssen die belebten Stoffe eine andere Art der Gleichgewichte darstellen. Es handelt sich hier um dynamische Gleichgewichte, sogenannte Fließgleichgewichte.
Auf Veränderungen reagiert das Lebewesen entweder langsam durch Anpassung oder schnell durch Vergiftung und Tod, das heißt Übergang in den anorganischen Zustand der Materie (Paracelsus, um 1500, "Die Dosis macht das Gift.").
|
|
 3.2.1 3.2.1 |
Untersuchung eines Atemzuges auf die Anwesenheit von Kohlenstoffdioxids
Vorwissen: Biologie: Atmen; Raumluft sollte Kohlenstoffdioxid enthalten, beim Kalkbrennen soll Kohlenstoffdioxid entstanden und ebenfalls in die Raumluft entwichen sein, gebrannter Kalk ist der Rückstand von Marmor beim Erhitzen, er zeigt die Eigenschaft der Chemikalienklasse "Lauge" und sollte mit dem Kohlenstoffdioxid wieder "Marmor" bilden.
Experiment:
|
|
1. Aufbau wie beim Kalkbrennen 1-3
2. Reinigen des "Mundstücks" oder Hinzunehmen eines sauberen "Pufferbereichs"
3. Funktion der Sicherheitswaschflasche |
Bild 5: Apparatur zur Untersuchung eines Atemzuges |
|
Ziel:
chemische Reaktionen sind umkehrbar; im Menschen laufen chemische Reaktionen ab; mit Chemikalien (Indikatoren) kann man Stoffe mit gegenteiligen Eigenschaften nachweisen;
Lernziele für das sicherheitstechnisches Denken:
- Übernehmen von persönlicher Verantwortung
- Umgang mit Chemikalien
- Recycling
- Restrisiko
|
|
 3.3 3.3 |
Aufgabe von chemischer Forschung und Chemietechnik
Die Naturwissenschaften beschäftigen sich mit den messbaren Eigenschaften der Natur. Antrieb dazu liegt in der Natur des Menschen, in der "Neugier". Ziel ist die Erkenntnisbildung. Zweck ist die Evolution, die Anpassung des Lebens an sich stetig verändernde Lebensbedingungen der Umwelt.
Der Mensch ist daran interessiert zu wissen, wie die Natur funktioniert, er will sie verstehen. Wenn er das denkend auf systematischem Wege herauszufinden versucht, nennt man das Forschung. Er macht das aber nicht nur aus "Spaß", er versucht seine Erkenntnisse zur Erleichterung seines Lebens einzusetzen. Dazu wendet er die Erkenntnisse in der Technik an, um seine Lebensbedingungen zu ändern mit dem Ziel sie zu "verbessern".
Diese Ziele werden auch von der chemischen Forschung verfolgt und finden ihre Anwendung in der Chemietechnik. Damit die Chemietechnik mit ihren heutzutage global wirkenden Auswirkungen nicht die Umwelt "vergiftet", ist ein nachhaltiges Denken und Handeln erforderlich.
|
|
| |
Die Grundlage für Nachhaltigkeit bilden die folgenden Erkenntnisse:
Anorganisch-chemische Gleichgewichte sind stabile, dynamische Gleichgewichte.
Organisch-chemische Gleichgewichte sind mettastabile, dynamische Gleichgewichte.
Biologische Gleichgewichte sind dynamische Fließ-Gleichgewichte, sie sind nur unter Stoff- und Energieaustausch mit der Umgebung aufrecht zu erhalten.
Alles Leben, auch der Mensch, hat sich im Laufe der Entwicklung an die Stoffe in seiner Umgebung angepasst.
Stoffliche Veränderungen (Chemische Reaktionen) sind immer mit Energieaustausch verbunden.
Dabei gebildete Stoffe befinden sich in dynamischen Gleichgewichten.
Entsorgen bedeutet Stoffe in den chemischen Zustand und die chemische Konzentration zurückzuführen, die im Stoffkreislauf der Natur bereits vorhanden sind.
Die Gefährdung, die von der Giftigkeit ausgeht, ist abgestuft nach Mobilität (Aggregatzustand):
- Unmittelbare Gefahr Gase: Unbekannte und gifte Gase erfordern wegen der Atmung apparativen Schutzmaßnahmen (z.B. dichte Apparatur, Abzug).
- Mittelbare Gefahr Flüssigkeiten: Unbekannte und giftige Flüssigkeiten dürfen nicht angefasst werden. Sie erfordern wegen der Aufnahme über die Haut persönliche Schutzausrüstung (z.B. Handschuhe, Schutzbrille).
- Nachhaltige Gefahr Feststoffe: Unbekannte und giftige Feststoffe sind kein "Abfall". Sie erfordern wegen der langfristigen Gefährdung zu nachhaltigen Schutzmaßnahmen (Sondermüll, Entsorgung, Recycling)
|
Nachhaltigkeit |
 3.3.1 3.3.1 |
Stickstoffdioxid - Darstellung, Untersuchung und Entsorgung
Vorwissen: geschlossenes System; natürliche Gleichgewichte; Gleichgewichte
Experiment (apparativer Anteil):
|
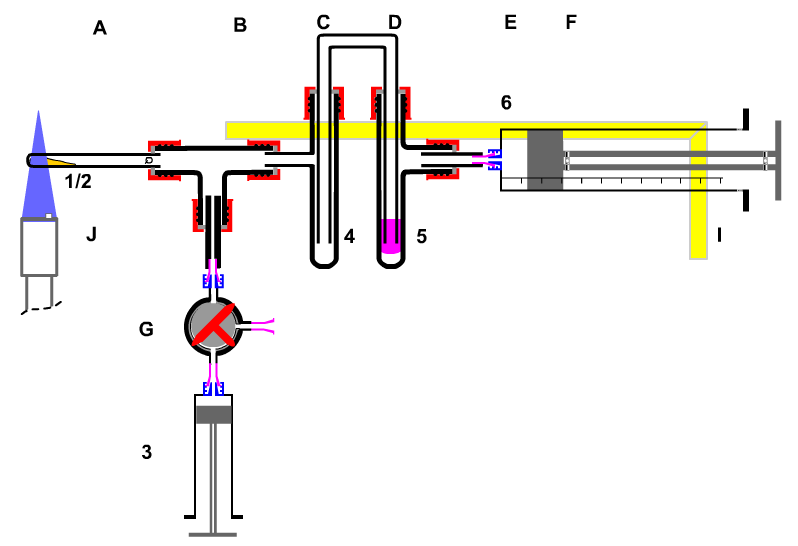
|
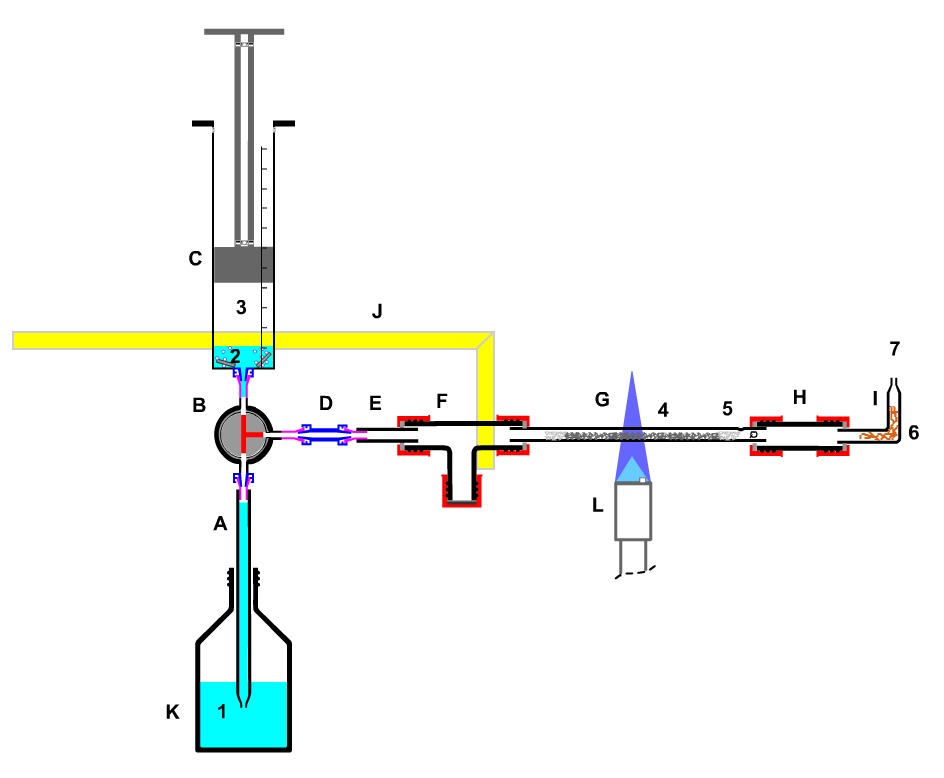
A Quarz-Glührohr
B T-Stück
C Sicherheitswaschflasche
D Gaswaschflasche
E Luer-Kupplung
F Kunststoff-Kolbenprober 50 mL
G Luer-Kupplung
H Kunststoff-Dreiwegehahn
I Kunststoff-Kolbenprober 10 mL
K Gasbrenner
1 ca. 50 mg Bariumnitrat
2 ca. 2 mL Harnstoff-Lösung (2mol/L)
3 ca. 3-4 mL Stickstoffdioxid |
| Bild 6: Apparatur zur Untersuchung des "Prinzips von Le Chatelier" |
Ziel des sicherheitstechnischen Denkens:
- Analyse der Gefährdung (Einstufung in die Schutzstufe nach GefStoffV);
- Risiko-Minimierung (Wahl der minimalen Stoffportionen)
- Ersatzstoff-Suche (
- sicherer und sachgerechter Umgang mit Gefahrstoffen in der Forschung;
| (I) |
Ba(NO3)2 |
--> |
BaO+N2O5(g) |
| (II) |
2 N2O5 (g) |
--> |
4 NO2+ O2 (g) |
| (III) |
NO2 (g) |
--> |
2 N2O4(g) |
| (IV) |
2 NO2 (g) + H2O |
--> |
HNO3+ HNO2 |
| (V) |
2 HNO2+ (NH2)2CO |
--> |
CO2(g)+3 H2O+2 N2(g) |
|
|
 3.3.2 3.3.2 |
Analytik - Identifikation einer unbekannten Flüssigkeit
Vorwissen:
- Man kann die Natur nur Erkennen an Unterschieden;
Unterschiede kann man im Labor nachstellen oder erzwingen.
Dabei sind die Vorsichtsmaßnahmen beim Umgang mit Gefahrstoffen für die bestehenden biologische Fließgleichgewichte einzuhalten.
- Alkohol ist ein Rauschmittel, Alkohole werden als Lösemittel verwendet;
- Informationsbeschaffung beim Hersteller einer Chemikalie, R- und S-Sätze; Umgang mit bekannten und möglicherweise unbekannten Stoffen.
Tabelle mit Daten zur Identifikation und Umgang mit ausgesuchten Alkoholen:
| Name |
Schmelz-
temperatur /[ °C] |
Siede-
temperatur /[°C] |
Dichte
d(20°C)
/[g/mL] |
Brechungs-
index
n(D, 20°C) |
Gefahren-
symbol |
| Methanol |
- 98 |
65 |
0,74 |
1,3288 |
T, F

 |
| Ethanol |
- 117,8 |
78 |
0,81 |
1,3614 |
F
 |
| 1-Propanol |
- 126 |
97 |
0,80 |
1,3853 |
F
 |
| 1-Butanol |
- 89 |
117 |
0,81 |
1,3993 |
Xn
 |
| 1-Pentanol |
- 79 |
138 |
0,81 |
1,4117
(D, 15 °C) |
Xn
 |
| die nachfolgende Zeile wird abgedeckt! |
| 2-Propanol |
- 89 |
82 |
0,78 |
1,3776 |
F
 |
Vorwissen:
- Umgang mit bekannten und gefährlichen Stoffen;
- Kennzeichnungspflicht des Herstellers einholen;
- Mit unbekannten Stoffen umgehen wie mit gefährlichen Stoffen
Experiment (sicherheitstechnisches Denken):
Ziel des sicherheitstechnisches Denkens: "Verursacherprinzip":
- Der Hersteller eines Dampfes ist Produzent einer aktivierten Substanz
- Der Hersteller einer gefährlichen Substanz muss die Informationen für den sachgerechten Umgang bereitstellen
- der Nutzer einer gefährliche oder unbekannten Substanz ist für den Gebrauch verantwortlich.
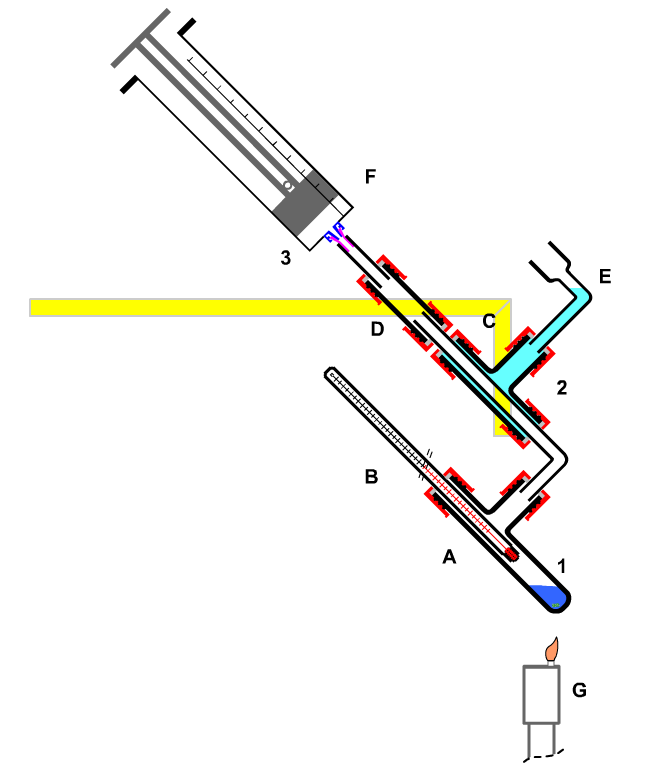 |
A Siedegefäß
B Thermometer
C Kühler
D Verbindungsstück
E,F Reservevolumen |
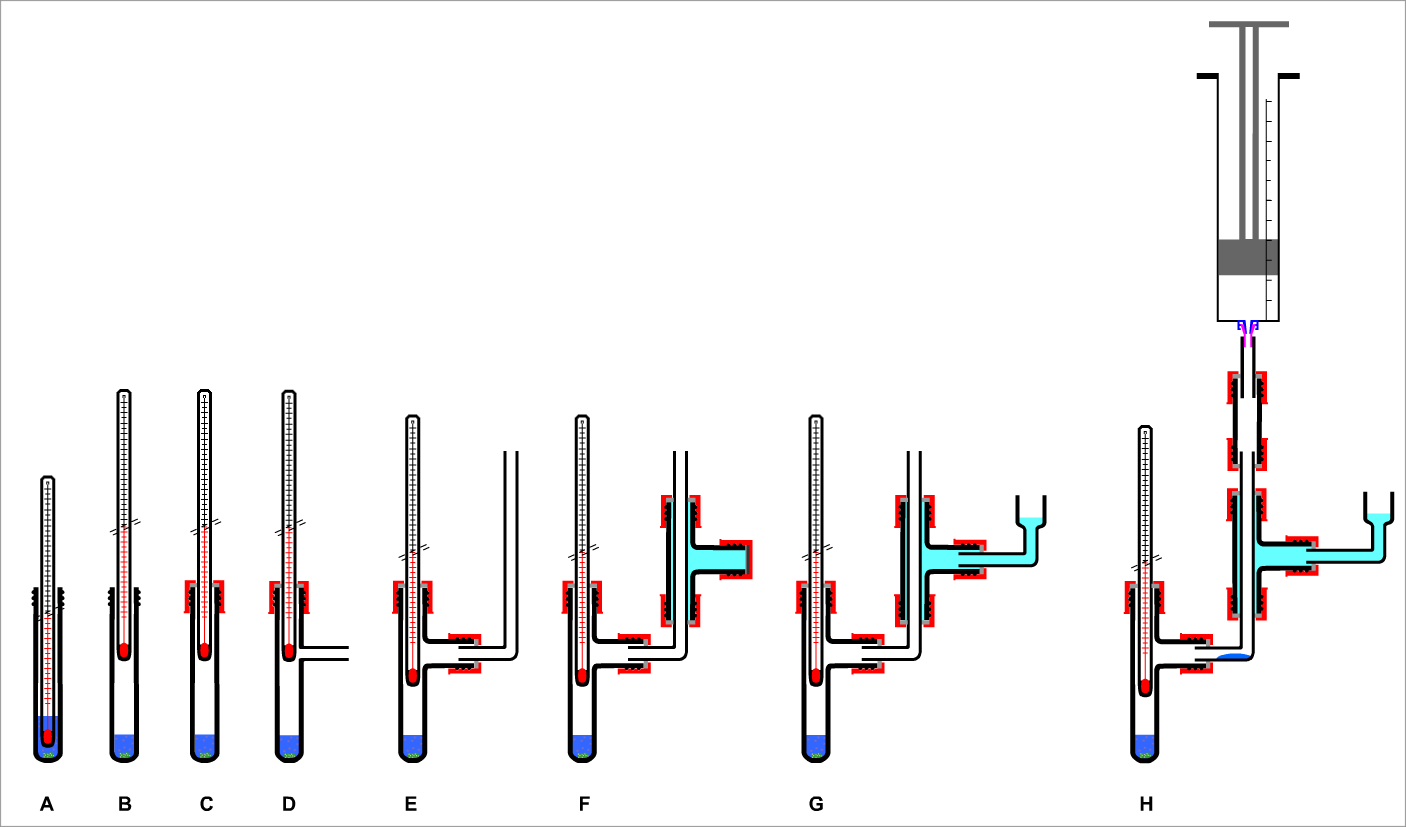
| Bild 8: Identifikation von Stoffen durch Bestimmung der Siedetemperatur |
|
|
|
 3.3.3 3.3.3 |
Chemische Bindung - Darstellung eines Esters aus Essigsäureanhydrid und Ethanol
Ziel: Umsetzung der Kenntnisse aus dem Umgang mit unbekannten Flüssigkeiten bei der Darstellung naturidentischer Aromastoffe
Vorwissen: Umgang mit unbekannten und gefährlichen Stoffen
| Essigsäureanhydrid + Ethanol |
--> |
Essigsäureethylester + Wasser |
Tabelle 2: Schmelz- und Siedetemperaturen von Alkoholen, Säuren und deren Ester;
Quelle: Gestis-Datenbank 
Der Link führt zur Suchmaske der Gestis-Datenbank  . In das Feld "Schnellsuche" muss der Verbindungsname ohne führende Positionszahl eingegeben werden, z.B Butylacetat . In das Feld "Schnellsuche" muss der Verbindungsname ohne führende Positionszahl eingegeben werden, z.B Butylacetat
Experiment:
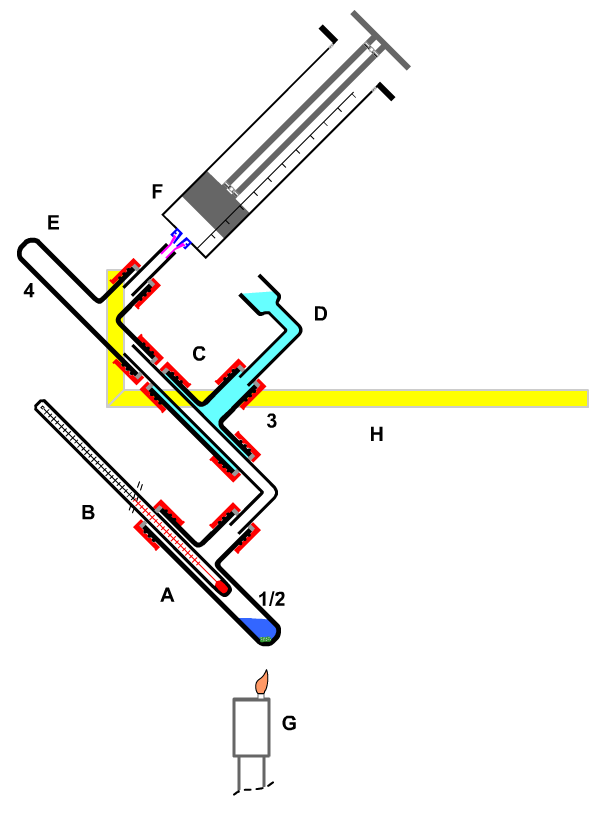 |
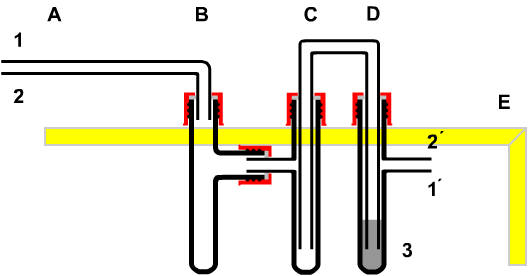
A Reaktionsgefäß
B. Tropfpipette
C, D Kühler
E,F Reservevolumen
H Stativ |
| Bild 9: Synthese durch Erhitzen unter Rückfluss in geschlossener Apparatur |
|
|
|
| |
Präparativer Ansatz eines naturidentischen Aromastoffes
Ziel: Darstellung Naturstoffen aus Chemikalien;
Identifikation von Stoffen durch Löslichkeit und Siedetemperatur (siehe Bild 8 Alkohole und Tabelle 2;
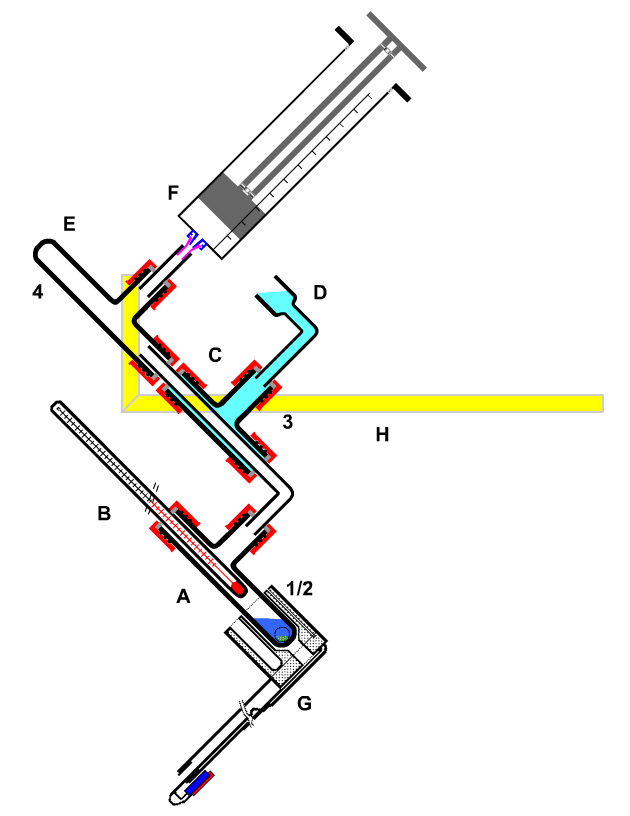 |
A, B Destillationsgefäß
C, D Kühler
E Vorlage
F Reservevolumen |
| Bild 10: Destillieren in geschlossener Apparatur; Destillieren mit Unterdruck |
|
�Entsorgung unter ökologischer Sicht:
- Verwendung naturidentischer Stoffe
- Entsorgung durch biologische Abbaubarkeit oder
- Überführung in abbaubare, bereits im natürlichen Gleichgewicht existierende Verbindungen
|
|
 3.3.4 3.3.4 |
Chemische Bindung - Natriumchlorid- Synthese aus den Elementen - Darstellung, Umsetzung und Entsorgung
Vorwissen:
- Bei Verwendung giftige Gase (Schutzstufe 3) is die Verwendung geschlossener Apparaturen erforderlich.
- Reaktionsräume unterschiedlichen Reaktionsverhaltens werden durch Puffervolumen getrennt.
- Vor dem Beladen einer Apparatur ist die leere Apparatur auf Dichtigkeit zu prüfen.
- Die Beladung der Apparatur geschieht in der Reihenfolge von fest über flüssig nach gasförmig und von ungefährlich nach gefährlich, zuletzt kommen die giftigen Gase.
- Am Ende einer chemischen Reaktion werden giftige Gas nach Möglichkeit "neutralisiert", gebunden oder gelöst
- Der Abzug dient nur der Sicherheit beim Befüllen und entleeren.
- Der chemische Prozess soll so geführt werden, dass noch bei Eintreten eines unvorhergesehenen Ereignisses "eine Hand zum Eingreifen" zur Verfügung steht.
Vor dem Experiment muss die Entsorgung geklärt sein, man stoppt eine Reaktion mit dem chemischen Antagonisten, die Entsorgungsmittel müssen im Überschuss angewendet werden können und dürfen damit nicht selbst Gefahrstoffe sein.
Um Reaktionsprozesse Gasen in kontrolliert in Gang zu halten, werden exotherme Prozesse entgegen dem Gasstrom, endotherme Reaktionen mit dem Gasstrom erhitzt.
Experiment:
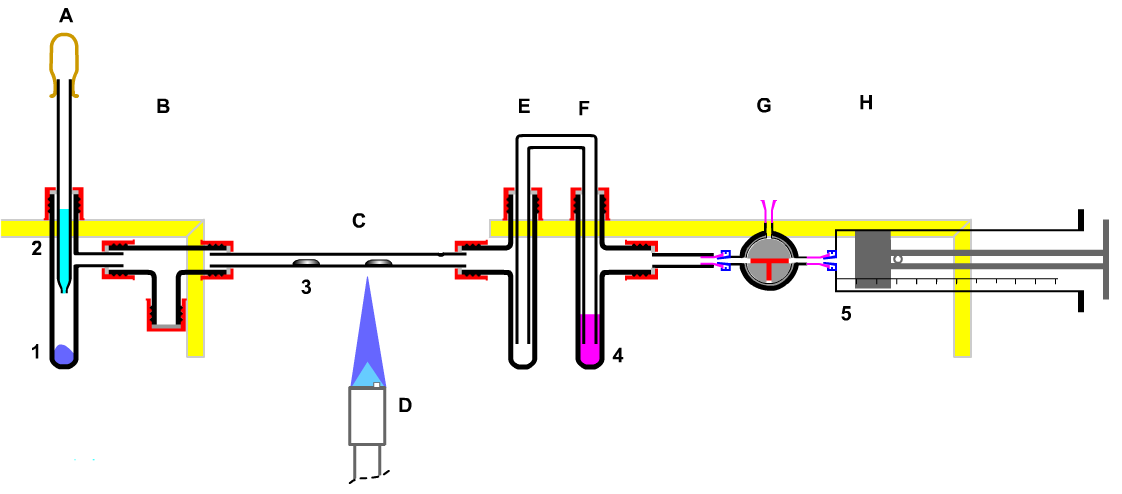 |
A Gasentwickler
B, E, H Puffer- und Reserve-Volumen
C Reaktionsrohr
F Gaswaschflasche
G Reservezugang
|
| Bild 11: Natriumchlorid-Synthese aus den Elementen mit Entsorgung |
|
| (I) |
CaCl(OCl) + 2 HCl |
--> |
CaCl2 + Cl2 + H2O |
| (II) |
Cl2 + 2 Na |
--> |
2 NaCl |
| (III) |
Cl2 + Na2S2O3 |
--> |
2 NaCl +H2SO4 + SO2 |
| (IV) |
SO2 + H2O2 |
--> |
H2SO4 |
|
|
 3.3.5 3.3.5 |
Umgang mit brennbaren Gasen (Wasserstoff), Redox-Prozesse;
Im Anschluss an die Bestimmung der Dichte von Luft bieten sich noch andere Gase an, wobei man schnell mit dem Umgang mit Gefahrstoffen konfrontiert wird. Die Bestimmung der Dichten von Stickstoff, Sauerstoff oder Kohlenstoffdioxid lassen das Erlernen des Umgangs mit Druckgasflaschen und Reduzierventilen notwendig werden. Beim Umgang mit Erdgas sind die Bestimmungen im Umgang mit brennbaren Gasen zu beachten.
In der Stoffklasse der brennbaren Gase ist der Wasserstoff von besonderem Interesse. Während Schülerinnen und Schüler im Bereich des Anfangsunterrichts von der Knallgas-Reaktion besonders fasziniert sind, ergeben sich für den wissenschaftlich-technischen Unterricht Möglichkeiten zum Einstieg in die quantitative Chemie und die technische Chemie der Metalldarstellung aus Metalloxiden.
Vorwissen: Das molare Volumen Vm eines idealen Gases bei Zimmertemperatur t = 20°C beträgt Vm(T = 293,15K)~ 24,055L/mol.
Die molaren Masse von Magnesium beträgt M(Magnesium)=24,3050g/mol.;
1 Mol Magnesium setzt 1 Mol Wasserstoff H2 frei.
Von den meisten Herstellern besitzt s=1 mm Magnesiumband in etwa die Masse m=1mg, gegebenenfalls muss man die Masse von 1m Magnesiumband ermitteln und umrechnen.
Anmerkung: Molares Normalvolumen T = 273,15K; p = 101325 Pa;
Vm= RT/p = 22,414 +/- 0,00019 L/mol;
Diese Beziehung lässt sich didaktisch vorteilhaft bei der Einführung des Molvolumens in der Sekundarstufe I ausnutzen.
Wegen dieser glücklicherweise guten Übereinstimmung der Maßzahlen, der Stöchiometrie der Umsetzung und des Zahlwortes milli ergibt sich
s=1 mm Magnesiumband -> m=1mg Magnesium -> V=1mL Wasserstoff.
Gibt man die Dichte von Wasserstoff (d=0,084g/mL) vor, so ergibt sich, dass 24 L Wasserstoff die Masse von etwa m(H2)=2g besitzen.
Da in der Regel zu diesem Zeitpunkt des Unterrichts die Gasgesetze und der Satz von Avogadro fehlen, kann an dieser Stelle nur die entsprechende Mitteilung weiterhelfen.
Experiment: Darstellung von Wasserstoff aus Magnesiumband und verdünnter Salzsäure; Umgang mit brennbaren Gasen; Explosionsgrenzen; evtl. Einführung der quantitativen Umsetzung bis hin zum Mol-Begriff.
|
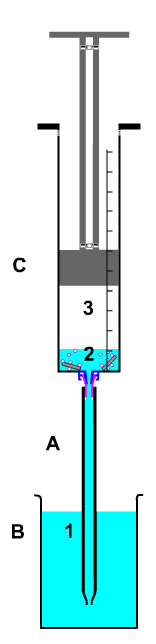 |
A Tropfer mit Luer-Lock-Anschluss
B Vorratsgefäß
C Kolbenprober
1 Säure
2 Säure mit Magnesium
3 Wasserstoff |
| Bild 12: Wasserstoff aus Magnesium und Essigsäure |
|
Der im Kolbenprober aufgefangene Wasserstoff kann anschließend in einem Filmdöschen zur Knallgasprobe benutzt werden.
|
|
| |
Redox-Prozesse bei der Darstellung von Wasserstoff aus Magnesium mit Salzsäure;
|
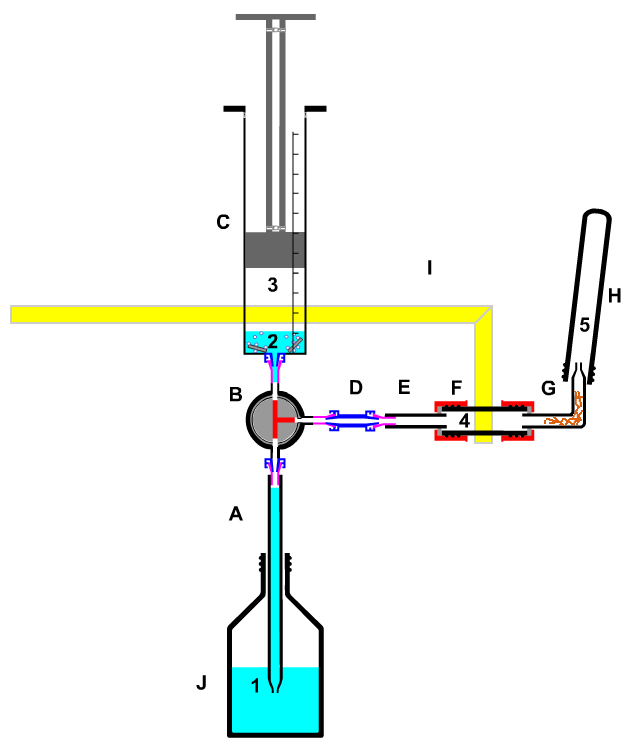 |
A-C, J Gasentwickler
D-F Verbindungsstücke
G Gasableitungsrohr mit Rückschlagsicherung
H Gasvolumen
1 Säurevorrat
2 Säure mit Magnesium
3 Wasserstoff
4 evtl. Trocknungsmittel
5 Wasserstoff
|
| Bild 13: Wasserstoff aus Magnesium und Essigsäure mit anschließender Knallgasprobe |
|
|
|
| |
Redox-Prozesse bei der Umsetzung von Sauerstoff mit Kupfer;
Redox-Prozesse bei der Umsetzung von Wasserstoff mit Kupferoxid;
Ziel: Redoxprozesse bei der Metallgewinnung
Die überwiegende Zahl von Metallen sind unedel, sie kommen in der Natur in der Regel in Form beständiger Verbindungen vor. Ern großer Teil bildet unlösliche Sauerstoff oder Schwefelverbindungen. Kupfer nimmt eine besondere Stellung ein, es ist halbedel. Das bedeutet, die Verbindung mit Sauerstoff ist relativ leicht herzustellen und wieder zu lösen. Kupfer, aber auch Eisen sind ungiftig und daher für den Einsatz in Schulexperimenten zu gebrauchen.
Im Experiment wird in einer Apparatur:
- zunächst aus (Luft-)Sauerstoff mit Kupfer Kupferoxid hergestellt.
- Anschließend wird Wasserstoff nach Bild 12 aus Magnesium mit Salzsäure gebildet.
- Danach wird das Kupferoxid mit dem Wasserstoff wieder zu Kupfer reduziert.
Der nach Bild 12 hergestellte Wasserstoff ist nahezu luftfrei. Er kann Plastik-Kleinfilmdöschen verbrannt werden. Dazu müssen die Filmdöschen mit einem Loch in der Mitte des Bodens und einem seitlichen Loch knapp unter dem Deckel vorbereitet werden. Je nach Menge des eingefüllten Wasserstoffs explodiert das Gas sofort oder verzögert, wobei die in der Regel die üblichen Begleitgeräusche zu hören sind.
Weiter lässt sich diese Technik zur Darstellung von Wasserstoff in Schülerübungen verwenden, mit dem Metalle reduziert werden können.
|
|
A-C,K Gasentwickler
D-F Puffervolumen
G Reaktionsrohr mit Metalloxid
H Puffervolumen/Indikator
I Rückschlagsicherung nach Davy |
| Bild 14: Darstellung von Wasserstoff zur Reduktion von Kupferoxid und Entsorgung durch Abbrennen |
|
|
|
| |
|
|
| |
|
|
 4 4 |
Literatur |
|
| |
Vortrag mit Übungen als Druckversion (.pdf)
Autor: Klaus-G. Häusler
 Klaus-G. Häusler: Soll und kann man die
Chemie des Schwefels noch unterrichten -
wenn man nichts mehr riechen darf!
Klaus-G. Häusler: Soll und kann man die
Chemie des Schwefels noch unterrichten -
wenn man nichts mehr riechen darf!
 Gestis-Datenbank des Instituts für Arbeitsschutz und Arbeitsmedizin der Deutschen Gesetzlichen Unfallversicherung DGUV
Gestis-Datenbank des Instituts für Arbeitsschutz und Arbeitsmedizin der Deutschen Gesetzlichen Unfallversicherung DGUV
 DGUV Deutsche Gesetzliche Unfallversicherung DGUV Deutsche Gesetzliche Unfallversicherung
|
|
 5 5 |
Anhang |
|
 5.1 5.1 |
Bilder
|
|
| |
Bild 1: Malerei aus der Gasulla-Schlucht zum Sicherheitsgrundsatz
Bild 2: Hauptsicherheitsingenieur zu Pferde
Bild 3: Schutzstufen (Dr. J. Häusler)
Bild 4: Apparatur zum Glühen von Marmor
Bild 5: Apparatur zur Untersuchung eines Atemzuges
Bild 6: Apparatur zur Untersuchung des "Prinzips von Le Chatelier"
Bild 7: Apparaturentwicklung zur Bestimmung der Siedetemperatur
Bild 8: Identifikation von Stoffen durch Bestimmung der Siedetemperatur
Bild 9: Synthese durch Erhitzen unter Rückfluss in geschlossener Apparatur
Bild 10: Destillieren in geschlossener Apparatur; Destillieren mit Unterdruck
Bild 11: Natriumchlorid_Synthese aus den Elementen mit Entsorgung
Bild 12: Wasserstoff aus Magnesium und Essigsäure
Bild 13: Wasserstoff aus Magnesium und Essigsäure mit anschließender Knallgasprobe
Bild 14: Darstellung von Wasserstoff zur Reduktion von Kupferoxid und Entsorgung durch Abbrennen
|
|
 5.2 5.2 |
Tabellen
|
|
| |
Tabelle 1: Tabelle mit Daten zur Identifikation und Umgang mit ausgesuchten Alkoholen
Tabelle 2: Schmelz- und Siedetemperaturen von Alkoholen, Säuren und deren Ester; Gestis-Datenbank
|
|
 5.3 5.3 |
Herstellernachweis |
|
| |
System Dr. Häusler
Firma Halbmikrotechnik - Chemie GmbH (HMTC) 
Geräte-Sets 
Eickenbecker Str. 7c
D-48 317 Drensteinfurt
FON: 0 25 38 / 9 51 92
FAX: 0 25 38 / 9 51 93
|
|
| |
"System Prof. Schallies"
ZINSSER ANALYTIK GMBH 
Minilabor-Experimente 
|
|
| |
"System Baumbach"
Hedinger 
Mikroglasbaukasten 
|
|
| |
"System Dr. Brand"
 Selbstbau-Anleitung und Experimente Selbstbau-Anleitung und Experimente 
Gefährdungsbeurteilungen (GefBu) 
|
|
| |
"System von Borstel"
Lebensnaher Chemieunterricht 
Chemie mit medizintechnischem Zubehör (.pdf) 
|
|
| |
Copyright 2005-2016 HMTC Halbmikrotechnik Chemie GmbH; www.halbmikrotechnik.de
|
|