Umsetzung der Gefahrstoffverordnung in den Chemieunterricht
|
||
| 1. Fragen zum Grundverständnis von Chemie
und Chemieunterricht Ziel des Chemieunterrichts ist es, den Schülerinnen und Schülern den sicheren und sachgerechten Umgang mit Stoffen, speziell mit Gefahrstoffen zu vermitteln. Die Beschäftigung mit Chemie soll Schülerinnen und Schüler auf die naturwissenschaftliche Denkweise vorbereiten. Von Phänomenen ausgehend, sollen Beobachtungen gemacht und gesammelt werden. Durch geplante Experimente sollen die Beobachtungen systematisch untersucht werden, nach Gemeinsamkeiten und Unterschieden sortiert und klassifiziert werden und schließlich durch Entdecken von "Regelmäßigkeiten" zu "Gesetzen" zusammengefasst werden. Die so gewonnenen "Naturgesetze" sollen durch Modelldenken erklärt und zu Vorraussagen genutzt werden. Die technische Nutzung soll der Naturwissenschaft Chemie soll die Lebensbedingungen aller Menschen verbessern. Bei der Umsetzung der Aufgaben des Chemieunterrichts treten Schwierigkeiten auf an Stellen, wo man sie nicht vermuten würde. Sie wurden in der Chemieausbildung übersehen und sind gleichzeitig ein Kennzeichen für den Mangel an Chemieverständnis. Man entdeckt sie bereits allesamt in der Zielsetzung des Chemieunterrichts. Die folgenden Fragen wurden nämlich bislang nicht thematisiert:
Der Chemieunterricht beginnt häufig, ob verbal oder experimentell, mit der Feststellung: Chemie befasst sich mit Stoffen, ihren Eigenschaften und deren Veränderungen. Beim Erlernen von Sprache werden Begriffe zunächst jedoch nicht definiert sondern "übernommen". Das führt zu zwangsläufig zu unscharfen Begriffen. Es ist daher zunächst zu klären: 1. Was kennzeichnet einen Stoff?
2. Was unterscheidet einen Stoff von einer Chemikalie? Stoffe, die sich nicht im natürlichen Gleichgewicht mit ihrer Umgebung befinden, kann man als Chemikalien bezeichnen.
3. Was versteht man unter sicherem Arbeiten? Es ist eine sehr alte Erkenntnis: Körperliche Abwesenheit ist besser
als Geistesgegenwart (Höhlenzeichnung Sie gilt genauso für die Chemie: Stoffe können nur miteinander reagieren, wenn sie sich berühren. Will man einer chemischen Reaktion vorbeugen, muss man in geschlossenen Apparaturen arbeiten. Erst wenn die Ungefährlichkeit eines unbekannten Reaktionsproduktes erforscht ist, kann man mit dem Stoff sachgerecht umgehen.
4. Was unterscheidet den sachgerechten Umgang vom sicheren Umgang mit Stoffen? Es wäre nicht evolutionär gedacht, wollte man die industrielle Chemie
vermeiden, um Gefahren auszuschließen ( siehe Karikatur Statt dessen muss gelten: Ein sachgerechter Umgang mit Stoffen hinterlässt Stoffe, die sich im chemischen Gleichgewicht mit den Stoffen der Umgebung befinden. Sollten Gefahrstoffen zwischenzeitlich gelagert werden müssen, so sind sie als solche zu kennzeichnen und sobald wie möglich in ungefährliche Stoffe umzuwandeln. Für den sachgerechten Umgang mit Stoffen sind erheblich mehr Kenntnisse erforderlich als für den sicheren Umgang. Bislang galt unausgesprochen, zumindest wurde so gehandelt: "Ein Stoff gilt solange als ungefährlich wie keine Schäden bekannt wurden." Deutlich wird das z.B. an der Gefahrstoffverordnung (GefStoffV)." Es fehlt das "negative" Gefahrstoffsymbol: Solange diese Einstufung nicht existiert, werden unbekannte Stoffe ungefährlichen gleich gestellt. Im Folgenden soll exemplarisch aufgezeigt werden, wie diese Inhalte des Chemieunterrichts durch Versuche in Halbmikrotechnik und geschlossenen Apparaturen gelehrt werden können.
|
Grundverständnis | |
| 2. Aufgaben des Chemieunterrichts
Die Schülerinnen und Schüler sollen
|
Aufgaben | |
| 3. Natürliche Gleichgewichte und
Reaktionen Unsere bisherige Erfahrung hat ergeben: Wirkt man auf natürliche Gleichgewichte mit Energie ein, so antwortet die Natur mit Reaktionen. Ziel von Reaktionen sind die Anpassung des natürlichen Zustands an die neuen Umweltbedingungen, so dass ein neues Gleichgewicht entsteht, für dessen Beibehaltung keine weiteren Reaktionen erforderlich sind. Prinzip von Le Chatelier (Prinzip des kleinsten Zwanges): Ein stabiles Gleichgewicht verschiebt sich bei Einwirkung von Energie so, dass es dem äußeren Zwang entgegenwirkt. |
natürliches Gleichgewicht | |
| 4. Stoff und chemische Reaktion Chemie befasst sich mit Stoffen, ihren Eigenschaften und deren Veränderung. Unter einer chemischen Reaktion versteht man eine Reaktion der Natur, bei der sich neue
Stoffe bilden. Neue Stoffe erkennt man an Veränderung der Eigenschaften.
Um Stoffe, die sich im chemischen Gleichgewicht befinden, zu chemischen Reaktionen zu bewegen, ist die Zufuhr von Energie notwendig. |
chemisches Reaktion | |
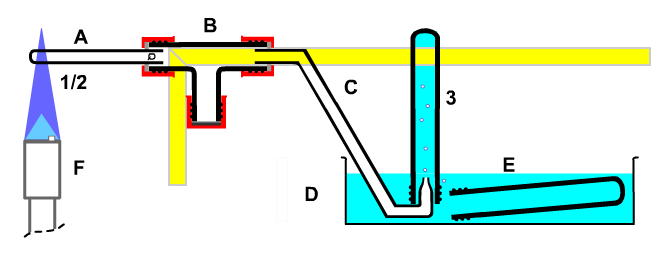
| 5. Umgang mit Stoffen Will man aus einem Stoff, der sich mit seiner Umgebung im Gleichgewichtszustand befindet, einen neuen Stoff herstellen, so kann man mit Energie auf ihn einwirken. (Eine andere Einwirkung wäre die Umverteilung [Entropie]). Im Labor benutzt man dazu einen Gasbrenner (Anleitung zum Umgang). Im Anfangsunterricht der Klasse 6 (Gymnasium) erhitzt man zunächst nur Luft in einem Quarzrohr. Bild: Apparatur zur Untersuchung der Ausdehnen und des Zusammenziehen von Luft beim Erhitzen und pneumatischer Wanne Dabei lernt man die Grundregeln für das Experimentieren im Labor und den Umgang mit Apparaturen. Die Schüler entdecken, dass sich Luft beim Erwärmen ausdehnt und beim Abkühlen zusammenzieht. Sie lernen aber auch, dass man beim Experimentieren Risiken eingeht, das etwas fehlschlägt, möglicherweise sogar mit Verletzungsgefahr. Bei Schülerübungen besteht das Risiko in der Gefahr des Zurücksteigens der Sperrflüssigkeit aus der pneumatischen Wanne, das vermieden werden muss und kann. Diese Gefahr ist besonders groß, wenn statt des kleinen Quarzrohrs ein großvolumiges Reagenzglas 16*160 mit Gummistopfen erhitzt würde. In der obigen Apparatur ist schon eine gewisse Vorsorge vor den Zurücksteigen getroffen, dadurch dass man das Quarzrohr nicht direkt über ein Schlauchstück mit dem Gaseinleitungsrohr der pneumatischen Wanne verbindet. Stattdessen ist ein T-Stück als Wasserfalle dazwischen geschaltet. Bild: Ausdehnen und Zusammenziehen von Luft beim Erhitzen |
||
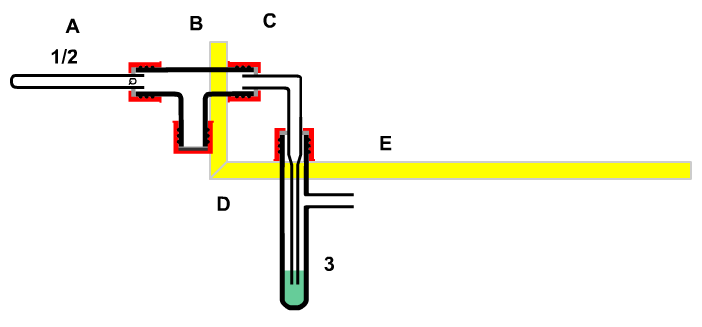
| 6. Vom Stoff zur Chemikalie Die Apparatur, mit der in der Klasse 6 Luft untersucht wurde, eignet sich auch als Einstiegsapparatur zur Untersuchung von Marmor. Im Verlauf des Versuches wird durch Glühen von Marmor ein Gas freigesetzt, das sich bei weiterer Untersuchung als Säure erweist. Es ist jetzt wichtig, wie man aus schon erkannten grundlegenden Erkenntnissen die Eigenschaften von gebranntem Kalk vorhersagen lässt. Die Erfahrungstatsache, alles in der Natur sich in einem Gleichgewicht befindet, gegründet einen der sechs Erhaltungssätze der Physik, der Energieerhaltungssatz. Der findet auch seine Anwendung in der Chemie bei der Umwandlung von Stoffen. Wenn also beim Brennen von Kalk unter Ernergizufuhr aus der Umgebung ein neues Gleichgewicht mit neuen Stoffen entstanden ist. so müssen sich diese neugebildeten Stuffe auch wieder under Energieabgabe in die Ausgangsstoffe zurückbilden können. Dazu muüssen die neu gebildeten Stoffe chemisch unterschiedliche, entgegengesetzte Eigenschaften besitzen. Da Kohlenstoffdioxid mit Wasser eine Lauge bildet, sollte man von dem Rückstand des Marmors, dem nun der säuremachende Teil fehlt, die entgegengesetzte Eigenschaft erwartet werden. Der gebrannte Kalk sollte mit Wasser eine Lauge bilden, die Säure und Lauge reagieren ihrerseits wieder zu Wasser und "Marmor". Ebenso lässt sich auch die "Entsorgung der neuen Chemikalien" planen, indem man die Antagonisten wieder vereinigt. Nach den Gesetzmäßigkeiten von Gleichgewichten sollte sich wieder "marmorhaltiges Wasser" als Endzustand einstellen. Tatsächlich zeigt eine Überprüfung, dass das "System" etwas von der Gleichgewichtslage abweicht - es ist schwach alkalisch! Da die Apparatur an einer Seite geschlossen ist, kann nur das neu gebildete Gas entwichen sein. Mit dem Entweichen des Stoffes wurde auch dessen chemische Reaktionsfähigkeit freigesetzt, es ist eine Chemikalien entwichen! Aus der Tatsache, dass man das Austreten nicht bemerken konnte, kann man vermuten, dass der Stoff bereits im natürlichen Gleichgewicht vorkommt. Andernfalls müsste der Mensch "von Natur aus" vor dem Auftreten eines giftigen Gases durch seinen Geruchssinn gewarnt werden. In der tat kann man alle in der Natur auftretenden giftigen Gase riechen! (Kohlenstoffmonooxid kommt in der Regel nicht in der Natur in merklichen Konzentrationen vor.) |
Stoff - Chemikalie |
|
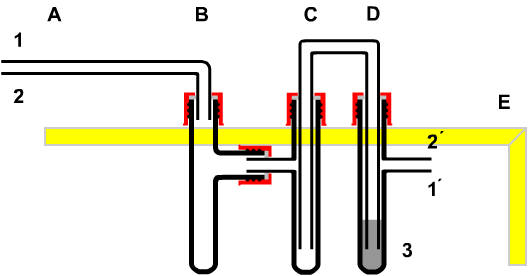
| 7. Vom anorganischen
dynamischen Gleichgewicht zum biologischen Fließgleichgewicht Es gilt daher die Vermutung zu prüfen, dass in der Raumluft bereits Kohlenstoffdioxid existiert. Dazu dient der Versuch der "Untersuchung von Atemluft". Bild: Apparatur zur Untersuchung eines Atemzuges Diese Apparatur kann in Schülerübungen eingesetzt werden, weil sie
Beim Experiment zeigt sich, dass in der Raumluft praktisch kein Kohlenstoffdioxid vorkommt, dagegen in der ausgeatmeten Luft. (nachgewiesen durch das selbst hergestellte "Kalkwasser" oder/und durch alkoholische Bromthymolblau- Lösung. |
anorganisches - biologisches Gleichgewicht |
|
| 8. Chemische Bindung
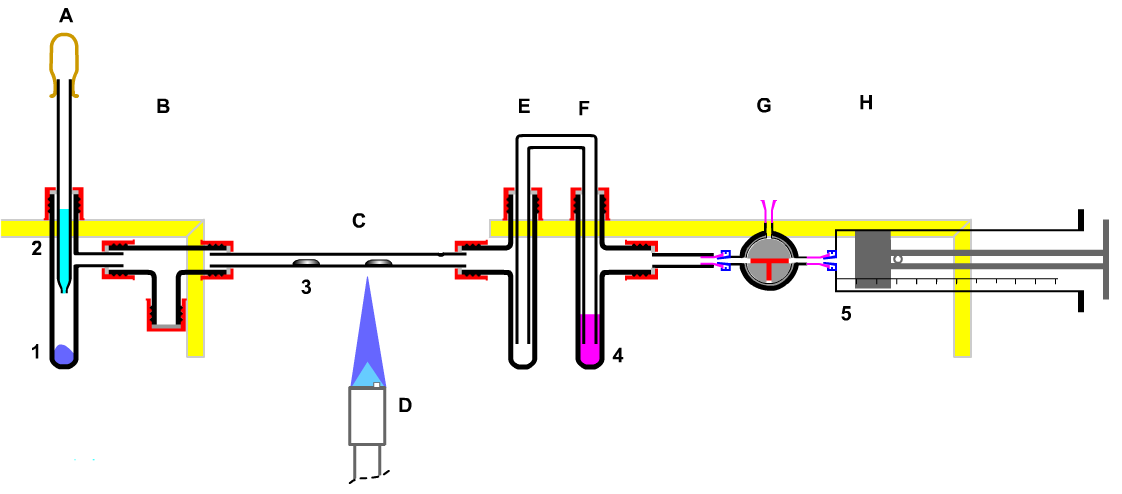
Ein Ziel der chemischen Forschung ist die Gewinnung neuer Erkenntnisse. Hier soll an Hand der Herstellung, der Untersuchung und der Entsorgung gezeigt werden, dass die Anleitung zum sicheren Experimentieren angewendet werden muss, wenn tatsächlich um gefährliche Stoffe handelt. Es wird ein Experiment zur Untersuchung der Gleichgewichtseinstellung nach Le Chatelier von Stickstoffdioxid <=>Distickstofftetraoxid durchgeführt. Vorgeschlagen wird folgende Apparatur:
Das Studium der chemischen Reaktionen, insbesondere die der Entsorgung macht deutlich, wie aus einer sicheren (d.h. dichten) Apparatur eine Apparatur für den sachgerechter Umgang mit Stoffen erwächst. Während man sich bei der Entsorgung von Salpetersäure ausschließlich auf das Neutralisieren und Verdünnen beschränken kann, muss man das Nitrit der Salpetrigen Säure reduzieren. Geeignet hierzu ist das Stoffwechselprodukt Harnstoff, weil es auch im Stoffwechsel von Lebewesen am Ende der Verwertung von Aminosäuren ausgeschieden wird. Die Aminosäuren sind gerade die von Nitrit angegriffenen Körperbestandteile. Durch die Redoxreaktion von Nitrit mit Harnstoff entstehen nur im natürlichen Gleichgewicht existierende Stoffe: Stickstoff, Kohlenstoffdioxid und Wasser. |
chemische Forschung | |
|
Nach dem gleichen Prinzip des sachgerechten Umgangs mit Stoffen und Chemikalien ist auch die folgende Synthese von Natriumchlorid (Kochsalz) aus den Elementen möglich. Das Tafelbild hierzu
mit den chemischen Gleichungen |
Kochsalz-Synthese | |
| Verfasser: Klaus-G. Häusler;
Literatur: |