Umgangsbeschränkungen
Stickstoffoxide
s-std6.htm 25.06.2004
|
Umgangsbeschränkungen s-std6.htm 25.06.2004 |
1 Zusammenfassung
Schülerinnen und Schüler lernen zu Anfang, das es natürliche Gleichgewichte gibt, die sich dadurch Auszeichnen, dass keine Veränderungen erkennbar sind. Zu diesen Gleichgewichten gehört auch die Existenz von Kochsalz in der Natur. Es findet sich im Meerwasser in Kontakt mit dem Sand, im Blut des Menschen und im den Pflanzensäften, ohne dass sich diese Stoffgemische chemisch verändern.
Schülerinnen und Schüler lernen bereits im Anfangsunterricht, dass zu Veränderung eines chemischen Gleichgewichts die Änderung der Existenzbedingungen von außen nötig ist, beispielsweise durch Erhitzen von Marmor.
Beim Erhitzen von Salzen wie zum Beispiel dem Calciumcarbonat entstehen die beiden Gegenspieler Kohlenstoffdioxid und Calciumoxid. Deutlich wird das in gegensätzlichem Verhalten stehen der beiden Stoffe, wenn sie in Wasser gelöst werden. Es entsteht aus Kohlenstoffdioxid mit Wasser Kohlensäure, mit Calciumoxid und Wasser Calciumhydroxid, Kalklauge. Ein Säure-Basen-Indikator zeigt, dass sich diese beiden Stoffe wieder neutralisieren und die zugeführten Wärme wieder abgeben, wenn sie zusammenkommen.
Man beobachtet aber auch chemische Reaktionen, wenn Stoffe miteinander in Kontakt kommen, die offensichtlich keine Gegenspieler sind, wie zum Beispiel die Reaktion von Natriumchlorid mit Schwefelsäure (Salzsäurespringbrunnen) oder Ammoniumsalzen mit Natriumhydroxid (Ammoniakspringbrunnen).
Die Stoffe passen sich den äußeren Bedingungen durch die chemische Reaktion an, so dass dann keine weiteren Reaktionen erkennbar sind (Gesetz von Le Chatelier). Das kann bei einer Gasrektion am Beispiel der Dimerisierung von Stickstoffdioxid gezeigt werden.
Evolution und menschliche Neugier
Leben konnte sich nur entwickeln, indem es sich an sich ändernde Umweltbedingungen anpasste. Es ist nur natürlich, dass das bewährte Prinzip auch für die Menschheit als Ganzes gilt.
Aber auch bei jedem Individuum ist das Prinzip Anpassung an Neues und Unbekanntes das Leitprinzip der Entwicklung. Es ist manifestiert in der "menschlichen Neugier".
Die menschliche Neugier hat aber auch natürliche Grenzen: Von unbekannten Umweltbedingungen, Situationen und Stoffen gehen Gefährdungen aus.
Die allem Umgang zugrundeliegende Regel lautet: Mit allen unbekannten Stoffen muss umgegangen werden wie mit Gefahrstoffen, bis ihrer Ungefährlichkeit bewiesen ist.
Während die Neugier des Individuums die Entwicklung des Heranwachsenden fördert, schützt die kollektiv angesammelte Erfahrung vor unkalkuliertem Risiko. In der Chemie sind diese Erfahrungen in "Umgangsbeschränkungen" festgelegt, die in der Schule eingehalten werden müssen. Sie sind abgestuft nach Lebensalter, Ausbildungsstand und Aufgabenbereich und finden sich beispielsweise in den sogenannten Betriebsbedingungen .
Wissenschaftliches Denken
Die Befriedigung der menschlichen Neugier schafft Informationen, die gesammelt, geordnet und zusammengefasst werden. Diese Tätigkeiten kombiniert mit dem analytischen Denken führt zu dem, was man Wissenschaft nennt. Wissenschaft dient keinem Selbstzweck. Die wissenschaftliche Forschung hat darüber hinaus den Zweck, aus den Erkenntnissen einen Nutzen für die Menschen zu ziehen. Daher müssen eventuelle Risiken bei der Erforschung abgewogen werden mit den zu erwartenden Gewinn an Erkenntnissen.
Schülerinnen und Schülern muss deutlich gemacht werden, dass chemische Forschung, die die bereits gewonnenen Erkenntnisse nutzt, mit geringerem Risiko behaftetet ist als die Vernachlässigung der Forschung aus Angst vor Gefahren. Dieses soll an der Untersuchung des Prinzips von Le Chatelier gezeigt werden, das mit Stickoxiden gezeigt werden kann.
Technische Anwendung
Das Abwägen von Nutzen und Risiko ist in besonderem Maße für die technische Anwendung der Chemie von Bedeutung.
Die Leistungen der Chemischen Industrie ist unbestritten und unverzichtbar. Sie werden in steigendem Maße genutzt, industrielle Gesellschaft ist ohne Nutzung der Chemie nicht denkbar. Das beginnt beim Wohnen, Heizen und der Kleidung, geht über Nahrung und Arzneimittel bis hin zur Kommunikation und dem Transport.
Die Akzeptanz der Chemischen Industrie nimmt jedoch in der breiten Bevölkerung der industrialisierten Gesellschaft ab. Die Ursachen sind vielschichtig.
Mangelhafte Kenntnisse führen zu Gefährdungen durch falschen Einsatz von Chemie. Das Beispiel Buttergelb, ursprünglich zum Färben von Butter eingesetzt, um "gesunde Sommer-Butter" vorzutäuschen, entpuppte sich als krebserregender Stoff.
Negative Auswirkungen von hemmungslosem Chemieeinsatz, der ursprünglich zum Nutzen der Menschheit gedacht war, führte zur Umkehr des Beabsichtigten. Beispiele sind hierfür die Pestizide z.B. DDT (Nobelpreis, heute weltweites Anwendungsverbot), Atrazin, Lindan, Tertiärbutylzinn.
Weiter sind es die Unfälle, die die Chemie in Verruf gebracht haben. Durch
die vergrößerten Dimensionen der technischen Anwendungen sind auch die Folgen
von Unfällen gravierender: Beispiel Bophal![]()
![]() ,
Sandoz (Rheinverunreinigung durch Löschwasser), Hoechst (Störfall durch
Bersten eines Reaktorgefäßes).
,
Sandoz (Rheinverunreinigung durch Löschwasser), Hoechst (Störfall durch
Bersten eines Reaktorgefäßes).
2 Menschliche Neugier und Evolution
Leben konnte sich nur entwickeln, indem es sich an sich ändernde Umweltbedingungen anpasste. Es ist nur natürlich, dass das bewährte Prinzip auch für die Menschheit gilt.
Es wird angenommen, dass die Menschheit in den tropischen oder Subtropischen Bereichen entwickelte, wo optimale Lebensbedingungen in Sachen Nahrung und Temperatur herrschten. Von dort aus breitete sich die menschliche Rasse in die gemäßigten Breiten aus. Hier wurde Heizen mit Feuer, Wärmeschutz durch Kleidung und Schutz vor Witterungseinflüssen und Jahreszeiten durch Behausungen nötig. Jahreszeiten mit Nahrungsmangel wurden durch Vorratsbildung und Konservierung überbrückt. Erstmals wurden gezielt biozide Wirkungen von Stoffen und unnatürliche Konzentrationen von natürlichen Stoffen gezielt eingesetzt: Garen mit Hitze, Räuchern, Einlegen in Alkohol, Essigsäure, Salz, Zucker.
Garen und Räuchern ist eng mit dem Thema "Holz und Holzprodukte" verbunden. Beim Räuchern nutzt man die biozide Wirkung des Holzteers.
In der Schule können bei allen Pyrolysen organischer Stoffe krebserzeugende Stoffe entstehen. In Schülerübungen sind diese Versuche sind nur dann zugelassen, wenn sie von Schutzmaßnahmen begleitet sind. Der Einsatz von krebserzeugenden, erbgutverändernden oder reproduktionstoxischen Gefahrstoffen als Edukte ist für Schülerübungen verboten.
Für den Umgang gefährlichen Stoffen gelten allgemeine Beschäftigungsverbote und Beschäftigungsbeschränkungen, die auch auf besondere Personengruppen eingehen (z. B. werdende und stillende Mütter)
Für Lehrerinnen und Lehrer gibt es besondere Umgangsbeschränkungen.
Da krebserzeugende Stoffe auch Bestandteile der natürlichen Umwelt sind, besteht daher eine besondere Verpflichtung diese in den Unterricht einzubeziehen. Hierfür wird wird Stoffminimierung als probates Mittel angegeben. Es ist zweckmäßig die Stoffminimierung auf Umgang mit allen Stoffen auszudehnen, besonders auf die Stoffe, die nicht nachgewiesen ungefährlich sind. Außerdem ist bei allen Experimenten zu prüfen, ob nicht mit Ersatzstoffen gleiche Erkenntnisse gewonnen werden können (Prüfung auf Ersatzstoffe).
Im Folgenden soll gezeigt werden, wie die Erkenntnisse zum "Experimentieren im geschlossenen System" mit denen Stoffminimierung und denen der "Entsorgung zu natürlich bestehenden Gleichgewichten" zusammengeführt werden können.
4 Geschlossene Apparatur
Experiment: Untersuchung des "Prinzip des kleinsten Zwanges"
am
Beispiel des Gleichgewichts Stickstoffdioxids / Distickstofftetraoxid
Nach §19 Abs. 1 GefStoffV sollen geschlossene Apparaturen verwendet werden, soweit es nach dem Stand der Technik möglich ist.
Die Apparatur zur Pyrolyse von Bariumnitrat, der Entnahme von Stickstoffoxiden und ihre Entsorgung ist eine Kombination aus zwei Apparaturen, die bereits seit dem Anfangsunterricht bekannt sind.
|
Die Kombination wird noch ergänzt durch eine Entnahme-Einheit und eine Einheit zur geschlossenen Apparatur |
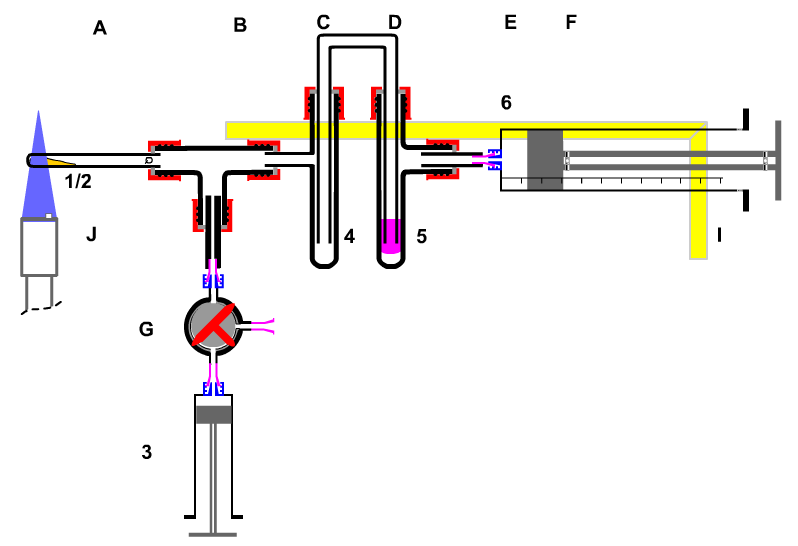
Bildung, Untersuchung und Entsorgung von Stickstoffoxiden |
5 Ersatzstoffprüfung
Für die Untersuchung
des Gasgleichgewichts 2 NO2 <=> N2O4 wird
Stickstoffdioxid benötigt, das sich auf mehrere Arten herstellen
lässt. Ein Teil davon ist di-Stickstofftetraoxid
(T+). Versuche damit sind daher nur als Lehrerdemonstrationsversuche zugelassen.
Stickstoffoxide bilden sich, wenn
Kupfer mit konzentrierter Salpetersäure reagiert. Diese Reaktion ist für die
Darstellung nicht gut so gut geeignet, da sich nach der Zugabe von
Salpetersäure zum Kupfer die Reaktion nicht mehr problemlos beenden lässt.
Im Rahmen der Ermittlungspflicht
ist zu prüfen, ob das Experiment nicht mit ungefährlicheren Stoffen
durchgeführt werden kann.
Hier bietet sich die thermische Zersetzung von Schwermetallsalzen an. Die
herkömmlich bekannte Verwendung von Bleinitrat
liefert Stickoxide. Der Vorteil: nach dem Ende des Erhitzen unterbleibt die weitere Bildung
von Stickoxiden sofort. Nachteile: Blei zählt zu den Stoffen, die beim Menschen
bekanntermaßen fruchtschädigend (entwicklungsschädigend) wirken. Außerdem
besteht der Verdacht, dass es auch zu den Stoffen gehört, die wegen möglicher
Beeinträchtigung der Fortpflanzungsfähigkeit des Menschen zur Besorgnis Anlass
geben. Es gelten daher alle Beschränkungen für werdende und stillende Mütter
und andere Schutzvorschriften.
Solche Stoffe werden nach Vorschlägen, die die Atomenergieindustrie entwickelt hat, eingeglast. Mit dem Bleioxid lässt sich ein sehr stark lichtbrechendes farbloses herstellen, das in der Glasindustrie als Kristallglas Verwendung findet. Diese Gläser gehören in den Sondermüll, nicht in den Glasmüll. Da das aber die Schwermetallentsorgung nicht das Thema ist, sollte auf den Einsatz von Blei auf ein anderes Schwermetall ausgewichen werden, das nicht so giftig ist.
Hier bietet sich Bariumnitrat
an. Es verhält sich bei der thermischen Zersetzung wie Bleinitrat,
ohne dessen fruchtschädigende und fortpflanzungsschädliche Wirkung zu
besitzen. Für die Zielstellung der Gasuntersuchung wird daher Bariumnitrat
gewählt.
Zur Durchführung des Versuches folge man der Arbeitanweisung
für die Halbmikrotechnik.
6 Stoffminimierung
In der Schule sollen ähnlich wie in der Wissenschaft Erkenntnisse gewonnen werden. Hierfür reichen kleine Stoffportionen in der Regel völlig aus, da die meisten Naturgesetze von der Größe der Stoffportion unabhängig sind. Bei der Minimierung eignet sich die Halbmikrotechnik besonders gut zum Einsatz in der Schulen (Näheres zur Halbmikrotechnik). In der Halbmikrotechnik geht man mit Stoffportionen in der Größenordnung von 0,1-2 mmol um. Damit lassen sich noch die laborüblichen Operationen durchführen.
Im Falle der Gleichgewichtseinstellung eines giftigen Gases sollte besonders darauf achten, das im Falle eine Unfalls und der Freisetzung des Gases der maximale MAK-Wert nicht überschritten wird. Für die Schule gilt noch eine Verschärfung, hier sollten 1/5 des MAK-Wertes nicht überschritten werden, da der Organismus in der Entwicklungsphase empfindlicher reagiert und nachhaltige Schäden leichter eintreten könnten.
Um Stoffe entsorgen zu dürfen, muss man eine staatliche anerkannte Berechtigung nachweisen, die die Sachkunde und technische Einrichtungen voraussetzen. In der Schule fehlen diese Grundlagen in der Regel. Daher dürfen in der Schule "Gefahrstoffe nur zur Entsorgung bereitgestellt werden". Die Abholung und Entsorgung geschieht durch ein lokales Entsorgungsunternehmen.
Ausnahmen bilden Experimente, bei denen "Entsorgung" ein Bestandteil des Experiments sind. Als solches sind Experimente in geschlossenen Systemen anzusehen, da in ihnen alle Stoffe verfügbar bleiben.
In diesem Falle müssen die entstandenen sehr giftige Stickstoffoxide und das Bariumoxid entsorgt werden.
Bariumoxid und überschüssiges Bariumnitrat können durch verdünnte Schwefelsäure in wasserunlösliches Bariumsulfat überführt werden, das mit dem normalen Müll entsorgt werden darf.
Für die die Entsorgung der Stickstoffoxide sind ausführlicher Überlegungen nötig. Das zunächst entstehende di-Stickstoffpentaoxid zersetzt sich spontan in Sauerstoff und di-Stickstofftetraoxid, von dem nur das letztere entsorgt werden muss. Dazu leitet man das gas in Wasser. dabei bildet vereinfacht Salpetersäure [Salpetersäure(V)] und Salpetrige Säure [Salpetersäure(III)]. Salpetersäure in der geringen anfallenden Stoffportion ist ungefährlich, sowohl von Säurepotential als auch von der Nitrat-Konzentration. Laut EG-Verordnung dürfen sogar bis zu 50mg/L Nitrat im Trinkwasser enthalten sein. Alleinig besorgniserregend ist demnach das Nitrit-Anion der Salpetrigen Säure [Salpetersäure(III)]. Es greift bei organischen Amin-Verbindungen an der Amin-Gruppe unter Bildung verschiedener Azo-Verbindungen an. Besonders gravierend ist daher die Einwirkung auf Eiweiß, Aminosäuren. Diese lebenswichtigen Verbindungen werden zerstört.
Es ist aber bekannt, dass der Körper beim Stoffwechsel überschüssige Aminosäuren nach der Umwandlung als Harnstoff ausscheidet. Im Harnstoff befinden sich immer noch zwei Amin-Gruppen.
In der Technik werden häufig Reaktionen eingesetzt, bei denen Stickstoffoxide entstehen sollen oder als unerwünschte Nebenreaktionen entstehen. Hierzu zählt die Verbrennung bei hohen Temperaturen im Automotor. In letzter Zeit werden hier besondere Anstrengungen unternommen, mit Hilfe von Katalysatoren Stickstoffoxide in Stickstoff und Sauerstoff zu spalten (HMT-Versuchsvorschrift folgt).
Ein weiteres Vorkommen ist die Herstellung von Anilinfarben, den Azo-Farbstoffen. Hierzu zählen die Bekannten Farbstoffe Anilingelb, Methylorange (HMT-Versuchsvorschrift folgt), Methylrot, Kongorot, Diamantgrün G.
Buttergelb, Dimethylgelb, p-Dimethylamonoazobenzol ist ein Azofarbstoff, der eine traurige Berühmtheit für die sinnlose Anwendung von Chemie erlangte. Ursprünglich als Farbstoff entwickelt, wurde es der Butter zugesetzt, um durch Gelbfärbung das "Natürlich-Gesunde" vorzutäuschen.
Da es jedoch bei Ratten Leberkrebs auslöst, wurde seine Verwendung als Lebensmittelfarbstoff 1938 in Deutschland verboten. Es ist jedoch weiterhin als Säure-Basen-Indikator mit einem Umschlagsbereich von 2,9-4,0 pH im Laboreinsatz.
Diazotierung: Durch Salpetrige Säure werden die primären Amine in Diazoniumsalze umgewandelt. Die Diazotierung erfolgt in saurer Lösung unter Eiskühlung (damit sich das Diazoniumsalz nicht zersetzt); die Salpetrige Säure wird im Reaktionsgemisch aus Nitrit und Schwefelsäure erzeugt.
[C6H5-NH3]+Cl- + HO-NO 
+ 2 H2O
Benzyldiazoniumchlorid
Die Diazoniumsalze gehen vielfältige Reaktionen ein.
Nitrosierung: Sekundäre Amine werden durch Salpetrige Säure (bzw. Nitrit + Säure) in Nitrosamine umgewandelt, wobei der Iminowasserstoff durch die Nitroso-Gruppe -NO ersetzt wird:
Die in der Regel gelben bis orangefarbenen, flüssigen oder festen, wenig wasserlöslichen Nitrosamine sind extrem krebserregend.
Hinweise auf die gesetzlichen Bestimmungen
Chemikaliengesetz ChemG
Gefahrstoffverordnung GefStoffV
veraltet: Richtlinie "Sicherheit im naturwissenschaftlich-technischen Unterricht" SiNTU
Organisatorisches
1. Besprechen
Anwesenheitsliste
2. Bereitstellen:
Leinwand; OH-Projektor, Beamer
3. Mitnehmen:
Laptop
Folien
Bar - Stickoxide
4 Halbmikro-Sets
© 1997-2003 HMTC
- Halbmikrotechnik Chemie GmbH;
Klaus-G.
Häusler ![]() uiw. at .halbmikrotechnik-chemie.de
uiw. at .halbmikrotechnik-chemie.de