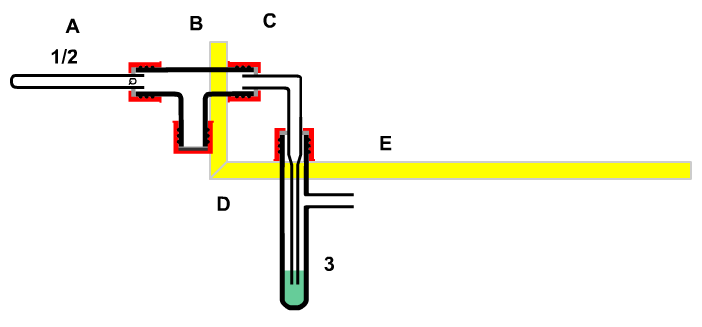
Umsetzung von Kupfer(II)-oxid mit Kohlenstoff, um die Gewinnung von Metallen aus Erzen zu zeigen.
- Glühendes Kupfer regiert an der Luft und bildet einen schwarzen, spröden Feststoff, der leicht abplatzt.
- im inneren blau leuchtenden Kegel der Gasbrennerflamme bildet sich wieder rot glänzendes Kupfer zurück, das sofort wieder beim Herausnehmen an der Luft den schwarzen Belag bildet.
Bild 1 : Apparatur zur Umsetzung von schwarzem Kupferoxid mit Kohlenstoff
(alternativ: rotes Kupfer(I)-oxid; Eisenoxide z.B. Fe3O4)
| Artikel-Nr. | Funktionsname | Preis (€, netto) |
| 6902 | Quarz-Glührohr ca. 80*8mm | 5,95 |
| 2203 | T-Stück, 3* GL18 | 22,70 |
| 2002 | HMT-Reaktionsgefäß GL18, L=100mm, seitl. Ansatz d=8mm | 7,70 |
| 3001 | GL18 Schraubkappe mit Loch | 1,38 |
| 3106 | Dichtung GL18, Loch GL16x8; PTFE-U-Stulpe | 3,03 |
| 3003 | GL18 Schraubverschluss mit Dichtung; Siliconelastomer/PTFE | 1,88 |
| 2001 | HMT-Reaktionsgefäß GL18, L=100mm | 4,40 |
| 1002 | Federklammer, d=16-18mm, Federn gegeneinander drehbar, kunststoffummantelt, bis 60°C | 5,06 |
| 1013 | Alu-Vierkantrohr, L-förmig; 280*90*10 mm | 14,30 |
| 1030 | Alu-Vierkantmuffe, bis 14mm Spannweite | 13,10 |
| 1 | 1100 | MBM-Fu▀wangensatz | 36,45 | d_1100 |
| 1102 | MBM-Dreifachschiene 25cm | 13,44 | d_1102 |
| 1 | 1105 | MBM-Schnellspannstab | 18,66 | d_1105 |
| Gasbrenner mit Sparflamme und Zündmittel |
| a001 | Schutzbrille |
| a006 | Gefäß zur Vereinigung der Rest-Chemikalien und Vorbereitung der Entsorgung |
alle Angaben sind als ungefähre Maßangaben anzusehen.
- erbsengroße Portion schwarzes Kupfer(II)-oxid
- zwei erbsengroße Portionen Kohlenstoff (gepulverte Aktivkohle)
- Kalkwasser
- etwa 2 mL verdünnte Essigsäure (c=2mol/L)
- etwa 0,5 mL konzentrierte Salpetersäure zum Reinigen des Quarzglührohr
Aufbau, Sicherheitsmaßnahmen und Entsorgung:
Beim Umgang mit Gefahrstoffen ist immer eine Schutzbrille zu tragen.
Die Apparatur besteht aus einem Glührohr aus Quarz (A), das durch eine Wasserfalle (C) von der Gaswaschflasche (D) (Borosilikatglas) getrennt ist. Nicht absorbierte Bestandteile können entweichen!
Die Apparatur wird zuerst komplett liegend auf dem Tisch zusammengebaut. Anschließend wird die gesamte Apparatur von der Rückseite her mit Federklammern (runde Kunststoffseite) versehen. In die Stahlseiten der Federklammern wird das Alu-Vierkantrohr eingelegt bis die Federklammern einrasten. Dabei soll das Glührohr frei im Raum hängen, damit es dort problemlos mit dem Gasbrenner bis zum Glühen erhitzt werden kann.
Die Apparatur wird auf Dichtigkeit
geprüft, indem man zunächst die Gaswaschflasche mit etwa 2 mL Reagenzlösung (3,D) füllt und anschließend fest verschraubt. Wenn man nun das leere Quarz-Glührohr in die Wasserfalle (C) schiebt, entweichen Gasblasen in der Reagenzlösung (3,D). Beim Zurückziehen des Quarzglührohres wird die Reagenzlösung im Gaseinleitungsrohr über das Niveau der äußeren Lösung angehoben. Die Apparatur ist bis zu zur Gaswaschflasche dicht, wenn das Höhenungleichgewicht bestehen bleibt..
Nun kann das Quarz-Glührohr etwa 2-3cm mit dem Gemisch aus Kupfer(II)-oxid und Kohlenstoff gefüllt werden.
Entsorgung:
Der Inhalt der Gas oder Flasche wird mit verdünnter Essigsäure gereinigt. Die Lösung kann ins Abwasser gegeben werden.
Das Glührohr wird unter dem Abzug konzentrierter Salpetersäure
gereinigt. Dabei entstehen giftige Stickoxide! Die entstehende Lösung wird zusammen mit dem festen Kupferrückstand in den Entsorgungsbehälter für Schwermetalle Salze gegeben.
Die Apparatur wird zuerst komplett liegend auf dem Tisch zusammengebaut. Anschließend wird die gesamte Apparatur von der Rückseite her mit Federklammern (runde Kunststoffseite) versehen. In die Stahlseiten der Federklammern wird das Alu-Vierkantrohr eingelegt bis die Federklammern einrasten. Dabei soll das Glührohr frei hängen, damit es dort problemlos mit dem Gasbrenner erhitzt werden kann.
Man mischt etwa eine erbsengroße Portion schwarzes Kupfer(II)-oxid (1) mit zwei erbsengroßen Portionen Kohlenstoff (2). Das Gemisch (1/2) gibt man in das Quarz-Glührohr (A). Falls man das Gemisch nicht vorher eine Stunde bei 120°C getrocknet hat, erhitzt man das schwarze Feststoffgemisch (1/2) im Glührohr (A) mit der entleuchteten Flamme sehr langsam, um das noch anhaftende Wasser zu vertreiben. Nach dem Trocknen erhitzt man das Gemisch (1/2) mit der rauschenden Flamme, dabei glüht es plötzlich auf. Sofort entfernt man den Brenner. Das Glühen pflanzt sich weiter selbstständig durch das ganze Gemisch fort. Gleichzeitig bildet sich in der angeschlossenen Gaswaschflasche ein weißer Niederschlag.
Nach dem Abkühlen des Quarzrohres untersucht man den Inhalt. Das Quarzrohr ist rot metallisch glänzend beschlagen. Der noch pulvrige Inhalt wird in ein Reagenzglas mit Schraubgewinde gegeben und mit Wasser versetzt und aufgeschüttelt. Nach dem Schütteln setzt sich ein fester Bodenkörper ab, übrig gebliebene Kohle oder Kupfer(II)-oxid wird dekantiert. Der Vorgang wird mehrere Male wiederholt. zuletzt wird der Bodensatz mit etwas Wasser auf Papier gegossen. Man erkennt einen rotbraunen körnigen Rückstand.
Der weißen Niederschlag sich in der Essigsäure löst sich leicht in verdünnter Essigsäure auf.
Umsetzung [A]: CuO,(s) + C(s) --> Cu + CO2 + Energie
Reaktion des Gases mit Wasser [D]: CO2 + H2O --> H2CO3
Kohlenstoffdioxid-Nachweis, 1. Schritt: : Fällung eines weißen
Niederschlages:
Ca(OH)2 +
H2CO3 -->CaCO3,s + 2 H2O
Kohlenstoffdioxid-Nachweis, 2. Schritt: ... der
sich mit verdünnter Essigsäure auflöst:
Ca(HCO3)2 + H2CO3 -->
"Marmor-Recycling"
1. Schritt: CaCO3(s) + 2 HAc,(aq)(Essigsäure) --> Ca-Acetat + H2CO3,(aq)
Kupfer(II)-oxid reagiert mit Kohlenstoff
unter Luftabschluss nach dem Erhitzen (Aktivieren). Das Aufglühen
zeigt, dass es sich um eine exotherme Reaktion handelt.
Dabei bildet sich ein Gas, das mit Kalkwasser einen weißen Niederschlag bildet, der sich leicht in verdünnter Essigsäure auflöst. Es handelt sich dabei um das Gas Kohlenstoffdioxid. Im Glührohr bleibt ein rotbrauner Stoff zurück, der in Wasser unlöslich
ist.
Verbindungsbildung mit Sauerstoff nennt man (vorerst) eine Oxidation. Die Entfernung von Sauerstoff aus einer Verbindung nennt man (zunächst) eine Reduktion.
In chemischen Reaktionen sind Reduktion und Oxidation immer gekoppelt. Weil sie immer gemeinsam auftreten, nennt man diesen Typ einer chemischen Reaktion eine Redox-Reaktion. Der Stoff, der Sauerstoff abgibt, ist ein Oxidationsmittel. Der Stoff, der den Sauerstoff aufnimmt, wird Reduktionsmittel genannt.
Ausblick:
Lässt sich die Reduktion von Kupfer(II)-oxid mit Kohlenstoff auch auf anderen Metalloxide übertragen?
Kann der Begriff der Redox-Reaktion auch auf andere Verbindungsbildungen (z.B. mit Chlor oder Schwefel) angewendet werden?
Copyright 2005-2015 HMTC Halbmikrotechnik Chemie GmbH; www.halbmikrotechnik.de