| 3.4.3. "Naturwissenschaftliche Denkweise am Beispiel der Induktive Denkweise |
|
Übersicht
|
||||||||||||
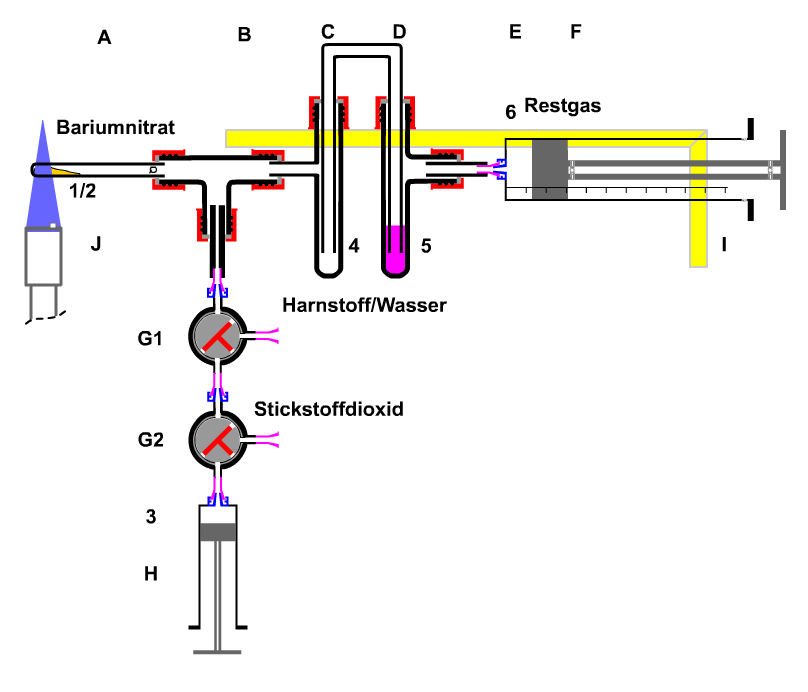
0. Didaktische Anmerkungen für den Workshop Durch Thermolyse von Bariumnitrat wird ein Gemisch von Gasen gebildet, das einen großen Anteil von Stickstoffdioxid enthält. Ziel der Darstellung des braunen Gasgemisches ist der optische Nachweis der Gültigkeit des "Prinzips des kleinsten Zwanges" Wegen der sehr großen Giftigkeit des Gasgemisches wird eine geschlossene Apparatur benötigt. An der verwendeten Apparatur lassen sich die grundlegenden Prinzipien der "Guten Laborpraxis". Die "Gute Laborpraxis" ist das Ergebnis der naturwissenschaftlichen Erkenntnisse und Erfahrungen. Diese Erfahrungen sind notwendig, um aus einer sicheren Apparatur eine Apparatur werden zu lassen, mit der sachgerecht mit den Stoffen umgegangen wird.
| ||||||||||||
1. Das Experiment
|
||||||||||||
2. Systematischer schrittweiser Aufbau der Apparatur aus halbmikrotechnischen Geräten Auszug für den Zusammenbau:
|
||||||||||||
Durchführung (extrem stark gekürzt):
Ausführliche Versuchsanleitung
Beladen Sie nun die Apparatur und beginnen Sie mit dem Harnstoff (5 in D). Fügen Sie Wasser hinzu. Nun erhitzen Sie das Bariumnitrat bis zur Schmelze. Dabei wird braunes Stickstoffdioxid frei (Thermolyse) und geht in das Probenvolumen (H) über. Hat man ca. 5-7mL Gas aufgefangen, entfernt man den Gasbrenner und verschließt beide Dreiwegehähne für alle Richtungen (eingezeichnete 45° Stellung). Das noch nachträglich entstehende Gas geht durch die Harnstofflösung und wird dort resorbiert. Zur Untersuchung des "Prinzip des kleinsten Zwanges" trennen Sie das Untersuchungsvolumen (H) von der Apparatur ab. Nun prüft man noch einmal, die Dichtigkeit der Gasspritze, indem man erst ca. 20 Sekunden einen Unterdruck zieht. Nach dem Loslassen sollte der Kolbenprober wieder fast bis auf das ursprüngliche Volumen hineingezogen werden. Nun drückt man das Gas etwas zusammen. Nach dem Loslassen sollte der Kolben wieder herausgedrückt werden. Diese beiden Endstellungen sind nicht gleich, weil die Reibung verhindert, dass sich ein druckloser Zustand einstellen kann. Das Volumen im drucklosen Zustand ist der Mittelwert aus den beiden Endstellungen. Für das Sichtbarmachen des "Prinzips des kleinsten Zwanges" hält man die Gasspritze über eine weiße Fläche und presst das Gasvolumen schlagartig zusammen. Die Farbe verdichtet sich zunächst nach dunkelbraun, hellt sich dann aber nach etwa 0,5 Sekunden wieder auf, weil sich aus dem braunen Stickstoffdioxid das farblose Distickstofftetraoxid bildet. Beim Entlasten geschieht der umgekehrte Vorgang. Zur Entsorgung der giftigen Gase wird das Probenvolumen wieder mit der Apparatur verbunden. Erst wird das ganze Gasvolumen durch die Harnstofflösung in das Abschlussvolumen (F) gesaugt. Dan wird das probenvolumen durch einen größeren mit Luft gefüllten Kolbenprober ersetzt. Durch mehrfaches Hin-und-her-Bewegen der Luft wird das Stickstoffdioxid von der Harnstofflösung absorbiert. - Wenn man die Lösung etwa 5-10 Minuten stehen lässt, bilden sich je nach der Menge des absorbierten Stickstoffdioxid kleine Bläschen.
|
||||||||||||
3. Gefahrstoff-Einstufung Für die folgende Analyse der Konstruktionsmerkmale ist die Kenntnis der Chemikalien und ihre Reaktionen erforderlich. Alle Angaben befinden sich in der gestis-Datenbank
Bariumnitrat Die chemischen Reaktionen im Einzelnen:
|
||||||||||||
4. Redundante Sicherheitsmaßnahmen Die Grundregel der chemischen Reaktion lautet: "Stoffe können nur dann miteinander reagieren, wenn sie sich berühren". Um also chemische Reaktionen am Menschen zu vermeiden, dürfen Chemikalien nicht mit dem Menschen dem Menschen in Kontakt kommen. Dazu dienen die persönlichen Schutzmaßnahmen, Schutzbrille, Handschuhe und Brille. Sie sind allesamt redundante Sicherheitsmaßnahmen. Die primäre Schutzmaßnahme ist die geschlossene Apparatur. - Eine geschlossenen Apparatur muss aber auch befüllt und entleert werden. Damit dabei aber keine gesundheitsgefährdenden oder giftigen Stoffe frei werden, wird ein Abzug benötigt. Apparative Maßnahmen Für die sichere Konstruktion einer chemischen Apparatur gilt die Umkehrung der Grundregel. Die Umkehrung lautet: "Stoffe mit unterschiedlichem Reaktionsverhalten müssen vor unbeabsichtigtem Kontakt durch Puffervolumina getrennt sein". Selbstverständlich müssen die bereitgestellten Puffervolumen so beschaffen sein, dass sie die eventuell übertretenden Stoffportionen vollständig aufnehmen können. Außerdem sollte eine Apparatur so geplant sein, dass die darin ablaufende Reaktion schnell abgebrochen werden kann. Eine chemische Reaktion sollten nicht unbeaufsichtigt betrieben werden. Operative Maßnahmen Zu allen chemischen Reaktionen den dazugehörenden Reaktionsbedingungen sind "Antagonisten" bereitzuhalten, um eine Reaktion zu stoppen. Wird während des Experiments erhitzt, so sind Notkühlungen zu planen, wird bei einer Reaktion ein Gas frei, so sind Ausweichvolumen vorzuhalten. Beim Entstehen von Säuren sind Laugen und umgekehrt bereitzustellen usw. Wird eine chemische Reaktion von einer Person durchgeführt, so ist die Apparatur so zu planen, dass sie notfalls mit einer Hand bedient werden kann. Die zweite Hand ist für das Eingreifen im Notfall als redundante Sicherheitsmaßnahme gedacht. - Allein Arbeitende sollten im Notfall Hilfe herbeirufen können. Bei allen Arbeiten in einem Labor geht es prinzipiell darum, Unbekanntes zu erforschen. Dabei bleibt ein Restrisiko. Unter dem Risiko versteht man das Produkt aus dem Grad der Gefährdung und der Wahrscheinlichkeit des Eintretens. Das verbleibende Restrisiko ist zu minimieren, wobei zu beachten ist, dass zu viele Sicherheitsmaßnahmen eine Steigerung der Gefährdung hervorrufen können. Nur wenn man gewillt ist, die Forschung ganz einzustellen, kann man das Forschungsrisiko auf "Null" drücken.
|
||||||||||||
5. Rückführung der Konstruktionsmerkmale auf Merkmale der "Guten Laborpraxis" |
||||||||||||
5a. Denken in Gleichgewichten Bariumnitrat ist ein Salz. Mineralische Ablagerungen sind kaum bekannt. Bariumnitrat wird durch Reaktion von z.B. Bariumcarbonat mit Salpetersäure hergestellt werden. Trotzdem kann man geringe Konzentrationen von Barium-Ionen im Trinkwasser finden. Barium-Ionen in größeren Konzentrationen sind giftig, da sie das für das Leben wichtige Calcium-Ion verdrängen. Beim Glühen wird auf das thermodynamisch stabile Bariumnitrat mit Energie eingewirkt. Dadurch entstehen die angeregten Stoffe Bariumoxid, Stickoxide und Sauerstoff. Bariumoxid ist als Lauge und würde durch das im Wasser gelöste Carbonat zu dem schwerlöslichen Bariumcarbonat ausgefällt. Die Löslichkeit ist jedoch noch so groß, dass es als gesundleitsschädlich eingestuft ist. Eine sachgerechte Fällung und Neutralisation geschieht durch Schwefelsäure. Hierbei bildet sich das sehr schwer Bariumsulfat (Mineral Schwerspat, Baryt). Die Löslichkeit ist so gering, dass Bariumsulfat in der Medizin sogar als Röntgenkontrastmittel eingesetzt wird. Stickstoffdioxid ist ein sehr giftiges Gas. Es kommt in der Atmosphäre nur ins Spuren bei Gewitter vor. wegen der größeren Dichte ist die Konzentration in Bodennähe deutlich größer. Stickstofdioxid entsteht technisch in Verbrennungsmototern und muss wegen der Umweltgefährdung im Abgas von Motoren durch Katalysatoren entfernt werden. In Wasser gelöst reagiert es durch Disproportionung in Salpetersäure und Salpetige Säure. Salpetersäure bildet in Wasser das Anion Nitrat. Laut Trinkwasserverordnung dürfen bis zu 50 mg/L im Trinkwasser vorhanden sein. Es biologisch von Wichtigkeit. Das Nitrat wird von den Pflanzen benötigt, um daraus den Stickstoffbedarf für den Aufbau der Aminosäuren zu decken. Salpetrige Säure bidet mit Wasser das Anion Nitrit. Laut Trinkwasserverordnung dürfen bis zu 1 mg/L im Trinkwasser vorhanden sein. Nitrit ist giftig und ist an der Bildung von kanzerogeen Nitrosaminen durch Reaktionen mit Eiweiß und anderen Aminen beteiligt. Harnstoff ist das Abbauprodukt von Eiweiß im Körper und damit Bestandteil des biochemischen Gleichgewichtes. Es ist ungiftig. Säure-Basen-Gleichgewicht: Wässrige Lösungen von Harnstoff und Bariumnitrat sind ph-neutral. Die zu entsorgenden Lösungen müssen ebenfalls neutral sein. Zwischenzeitlich gebildetes Barytwasser (Ba(OH)2,aq mit den äquimolaren Mengen an Salpetersäure und Salpetersäure neutralisieren. Da sich die Stofffe an verchiedenen Stellen der Apparatur befinden, ist eine Rückführung Bariumnitrit und -nitrat unpraktisch. Eine Immobilisierung von Barytwasser durch Kaliumsulfat wäre technisch sinnvol. In biologischen Gleichgewichten ist eine saure Lösung jedoch verträglich, deshalb kann statt Kaliumsulfat auch eine sehr geringe Portion Schwefelsäure zur Bildung von Bariusulfat eingesetzt werden. Redox-Gleichgewicht: Nitrate und Nitrite sind starke Oxidationmittel. Im biologischen Gleichgewicht sollten diese Stoffe daher nicht in zu großen Konzentrationen auftreten. Insbesondere das Nitrit wird biozid eingesetzt, z.B. als Oxidationsmittel im Pökelsalz zum Haltbarmachen von Fleisch. Biologisches Gleichgewicht: Die neutralisierten Lösungen können ins Abwasser gegeben werden. Da Chemiker von der Ausbildung her nicht den gesetzlich vorgeschrieben Nachweis der "Sachkompetenz zur Entsorgung" haben, dürfen Chemiker normalerweise gefährliche Stoffe nur zur Entsorgung bereitgestellt werden. Gleiches gilt auch für Chemilehrer. Für den Chemieunterricht gibt es jedoch eine Ausnahme: Wenn die Entsorgung Bestandteil des Unterricht ist, durfen Lehrer auch Chemikalien entsorgen.
|
||||||||||||
5b. Labortechnische Antagonisten Erhitzen oder exotherme Reaktionen sollten als Gegenmaßnahmen Kühlung vorhalten. Überdruck sollte durch Unterdruck begegnet werden. Bei Volumenausdehnung sollte Reservevolumen vorrätig sein. Starke Oxidationsmittel können durch Reduktionsmittel entsorgt werden und umgekehrt. Starke Säuren können durch Basen neutralisiert werden und umgekehrt. Giftige Liganden werden durch ungiftige Zentralatome gebunden. Umgekehrt können giftige Zentralatome durch unschädliche Liganden gebunden werden. Als Entsorgungsmittel eignen sich amphotere Stoffe. diese sind in der Regel in biologischen Gleichgewichten ohnehin vorhanden und deshal auch im Überschuss eingesetzt nicht giftig. Redoxamphoter: Eisen(II)-/Eisen(III)-Lösung Säure-Basen Amphoter: Natriumhydrogencarbonat-Lösung Ligand-Zentral-Atom-Antagonisten:
|
||||||||||||
5c. Entsorgungskonzept der "Soester Liste" Die "Soester Liste" ist eine Sammlung von Ausarbeitungen über den Umgang mit Gefahrstoffen in Experimenten. Sie wurden vom ehemaligen Landesinstitut für Schule in Soest (NRW).
|