 |
Einstiegsexperimente und Materialien
für die Lehrerfortbildung
service/chemie/didaktik/lfb/einstieg.html, V_1, 07.12.2017
|
|
|
Inhaltsverzeichnis
1. Redox-Chemie am Beispiel Cu/CuO // H2/H2O // Mg/MgX2
2. Luft und Stoffbegriff
2.1. Platzbedarf
2.2. Masse
2.3. Temperatur
3. Kalkkreislauf
4. Carbonsäureester
5. Stickstoffdioxid/di-Stickstofftetraoxid Gleichgewicht
6. Springbrunnen
|
|
 |
1. Einstiegsexperiment für die "Landesweite Lehrerfortbildung NRW
In eine halbmikrotechnischen Apparatur sollen nacheinander drei Redox-Vorgänge demonstriert werden, ohne dass die Apparatur nach dem Beladen mit Chemikalien zwischendurch wieder geöffnet werden muss.
Es soll
- Kupfer mit Luftsauerstoff oxidiert werden,
- Wasserstoff aus Magnesium und Säure hergestellt werden, wobei die entsprechende Salze des Magnesiums(ohne Nachweis) entstehen,
- der gebildete Wasserstoff zur Reduktion des zuvor hergestellten Kupferoxid verwendet werden, wobei das Oxidationsprodukt Wasser nachgewiesen werden kann.
Das Einstiegsexperiment der Lehrerfortbildung ist das
abschließende Experiment der Unterrichtsreihe Reduktion-Oxidation für Schülerinnen und Schüler im Alter von 12-14 Jahren. für Schülerinnen und Schüler im Alter von 12-14 Jahren.
Zum einzelnen Experiment
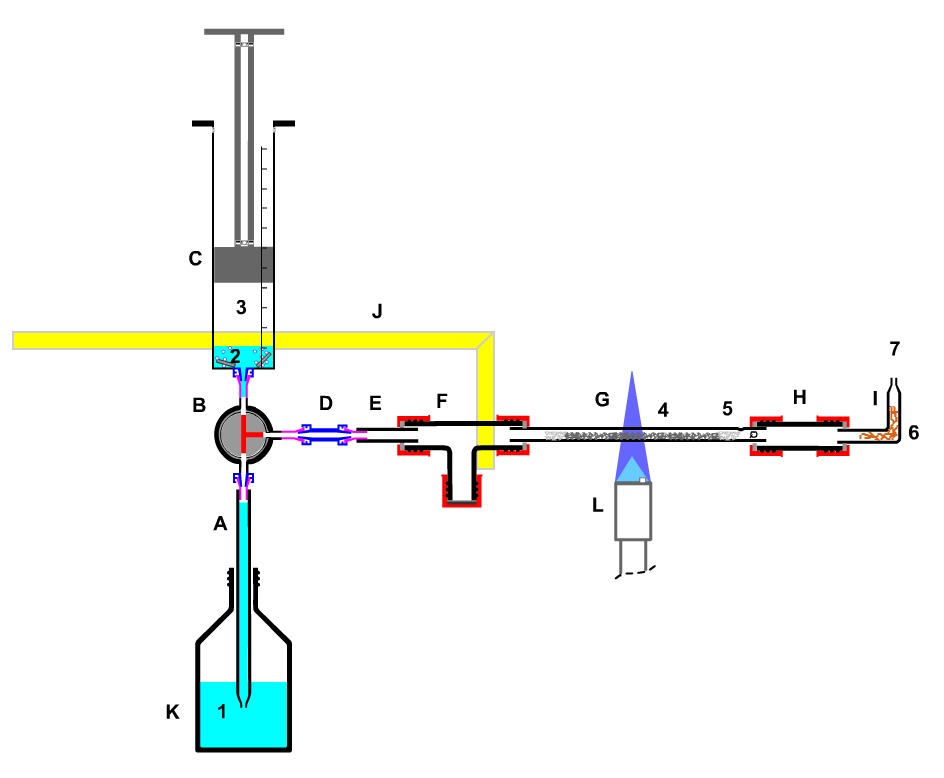
Bild: Gasentwicklung von Wasserstoff aus Magnesium und Säure sowie
Umsetzung des Wasserstoffs mit Kupferoxid
| 9816.0 |
Redox-Apparatur (Stand 1.11.2016) |
115,00 € |
| 1000 |
2 Stk. Federklammer, d=16-18mm, Edelstahl, Federn gegeneinander drehbar |
10,40 |
| 1013 |
1 Stk. Alu-Vierkantrohr, L-förmig; 280*90*10mm |
6,58 |
| 1030 |
1 Stk. Alu-Vierkantmuffe, bis 14mm Spannweite |
13,10 |
| 2201 |
1 Stk. Verbindungsstück, gerade; GL18-GL18 |
9,90 |
| 2203 |
1 Stk. T-Stück; 3*GL18 |
22,70 |
| 3001 |
4 Stk. Schraubkappe mit Loch; GL 18 |
5,52 |
| 3003 |
1 Stk. Schraubverschluss mit Dichtung; GL18; PTFE/Siliconelastomer |
1,88 |
| 3106 |
4 Stk. Dichtung GL18 mit Loch GL16x8; PTFE-U-Stulpe |
12,12 |
| 4204 |
1 Stk. Kunststoffspritze, 3-teilig; für wässrige Lösungen und Gase, 50(60)ml; LL-M; Silikonelastomerkolben |
2,90 |
| 4301 |
1 Stk. Pipetten-Ansatz mit Luer-Lock (innen); 1*Luer-FM; PE - Borosilikat-3.3 |
4,31 |
| 4303 |
1 Stk. Tropfpipette mit Luer-Lock-Adapter; L = 130*8/1,5mm; 1*Luer-FM; PE - Borosilikat-3.3 |
6,90 |
| 4443 |
1 Stk. Luer-Lock-Kupplung mit Überwurfmutter; LL-M/M |
1,52 |
| 4446 |
1 Stk. LL-Dreiwegehahn-Kunststoff; 2*LL-M, 1*LL-FM |
2,45 |
| 6011 |
1 Stk. Gasableitungsrohr, kurz mit Spitze, 90°; d=8mm; |
2,95 |
| 6901 |
1 Stk. Quarz-Reaktionsrohr mit Verjüngung; 150*8mm |
13,10 |
| 6802 |
1 Stk. Glasrohr; Länge ca. 120mm; d=8mm, Wand=1,5mm; |
1,47 |
| 6903 |
1 Stk. Quarzwolle, 2g; in PP-Flasche |
3,46 |
|
Geräte:
A Pipette mit Luer-Lock-Anschluss
B Dreiwegehahn
C Kunststoff-Kolbenprober
D Kunststoff- Kupplung
E T-Stück
F Luer-Lock- Adapter
G Reaktionsrohr (Quarz)
H gerades Verbindungsstück
I Glasrohr mit Spitze
J Stativwinkel
K Gefäß
L Gasbrenner
Chemikalien und Hilfsstoffe:
(1) ca. 200 mg Magnesium,
(2) 50 mL verd. Salzsäure (Salpetersäure ist wegen der Bildung nitroser Gase ungeeignet!)
(3) Wasserstoff
(4) Kupfer(II)-oxid
(5) Quarzwolle
(6) Kupferspäne (Rückschlagsicherung)
(7) Abgas |
Vorwissen der Schüler:
»Luft und Stoffbegriff« ( Abschnitt 2. s.u.) unter anderem mit dem Themen
»Umgang mit gefährlichen Stoffen« am Beispiel der Säuren, Laugen und Indikatoren, wie sie im Schüler-Handapparat enthalten sind.
|
|
 |
2. Luft und Stoffbegriff
 Leitseite zum Thema: Luft und Abluft Leitseite zum Thema: Luft und Abluft
|
|
 |
2.1. Platzbedarf
< |
Im Anfangsunterricht fällt oft der Satz: "Chemie befasst sich mit Stoffen, ihren Eigenschaften und deren Veränderung." Dabei wird häufig stillschweigend vorausgesetzt, dass man weiß, was ein Stoff ist. Kinder, aber auch viele Erwachsene, können in der Regel nicht benennen (definieren), was einen Stoff ausmacht. Der Chemieunterricht baut aber auf dem Stoffbegriff auf. Deshalb ist möglichst frühzeitig nötig, nachdem ein Anfangsinteresse an Stoffumwandlungen bei Kindern geweckt ist, eine "Definition" des Begriffes zu geben und experimentell zu festigen.
Definition: »Alle Stoffe besitzen Masse, Platzbedarf und Energie in Form von Wärme.«  stoff_didaktik.htm stoff_didaktik.htm
|
Die Annahme, dass Luft ein Stoff ist, muss also nachwiesen werden. Dazu muss man entweder den Platzbedarf, die Masse oder die Wärme bestimmen. Hat ein Stoff eine Eigenschaft, so hat er auch die anderen.
Für den Platzbedarf ist der Nachweis einfach (Abbildung nebenstehend).
Um den Platzbedarf zu zeigen benötigt man keine "Apparatur". Ein einfaches Glasrohr reicht aus, um Luft abzutrennen und ihre Anwesenheit bemerkbar zu machen.
|
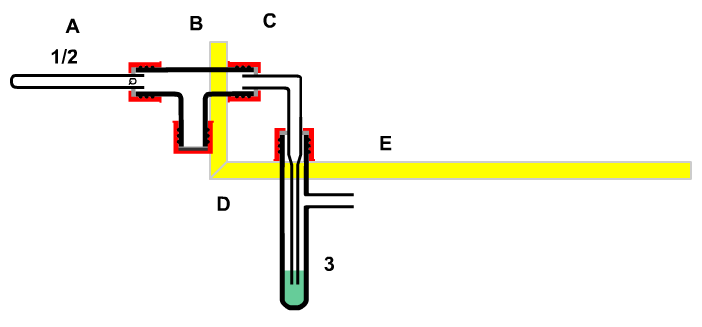 |
Man kann die Natur nämlich nur erkennen, wenn man Unterschiede erkennen kann. Um Luft sichtbar zu machen, benötigt man bereits eine Apparatur. Dazu muss man den naturwissenschaftlichen Regeln zu Folge einen Teil der Luft von der gesamten Luft der Erde abtrennen und auf diesen Teil eine Zwang (Energie) anwenden. Den abgeteilten Teil nennt man System, den Rest Umgebung. Was so verklausuliert klingt, wird in der nebenstehende Apparatur verwirklicht.
|
In der einseitig offenen Apparatur befindet sich Luft (1/2), die durch eine Sperrflüssigkeit, angefärbtes Wasser (3), von der Außenluft getrennt ist.
Wenn man an der Apparatur das Glühröhrchen (A) in die Wasserfalle (B) drückt, entweicht Luft (1/2) durch das Wasser (3) in der Gaswaschflasche (C) in Form von sichtbaren Blasen. Daraus folgt: Luft ein Stoff, weil sie einen Platzbedarf hat: »Wo ein Stoff ist, kann kein anderer sein.«
Zieht man nun das Glühröhrchen wieder zurück über die Ausgangsstellung hinaus, so steigt eine dem größeren Platzangebot entsprechende Portion Wasser (3) im Einleitungsrohr der Gaswaschflasche (C) zurück über den Gleichstand innen und außen hinweg, ohne wieder abzusinken. »Wo kein Stoff ist, muss einer hin. Es gibt keinen absolut leeren Raum.«
|
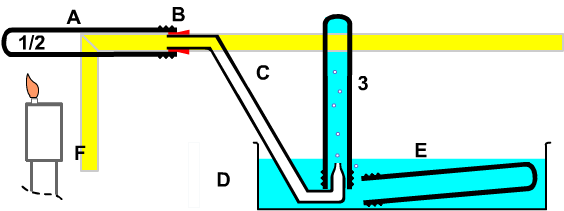
Bild: Handversuch zum Nachweis der Abhängigkeit des Platzbedarfs von Luft von der Temperatur |
Mit einem Handversuch kann man zeigen, dass Luft sich beim Erwärmen ausdehnt und beim Abkühlen zusammenzieht. Dazu benötigt man die nebenstehende Apparatur.
»Stoffe können nur miteinander reagieren, wenn sie sich berühren.«
|
Achtung: Das Erhitzen des Reaktionsrohres (a) mit der darin enthaltenden Luft (1/2) darf nur mit der warmen Hand oder ganz kurz und vorsichtig mit der Sparflamme eines Gasbrenners geschehen. Beim Abkühlen steigt das Sperrwasser (3) zurück und kann unter Umständen bis in das warme (heiße) Reaktionsgefäß gelangen!
Das sollte bei einer sicheren Apparatur unbedingt vermieden werden.
Will man das Gas sehr stark erhitzen, so muss man ein Quarzrohr statt eines Kolbenprobers verwenden. Hierbei besteht die Gefahr, dass das Wasser beim Abkühlen zurücksteigt und es in dem noch glühenden Quarzrohr zu einer explosionsartigen Verdampfung kommen könnte. Daher verkleinert man das Wasservolumen und fügt eine Wasserfalle statt des Verbindungsstücks ein.
|
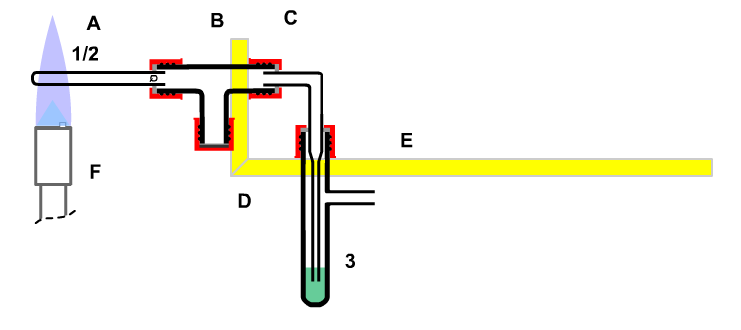
Bild: Nachweis der Abhängigkeit des Platzbedarfs von Luft von der Temperatur
|
Besser ist daher die nebenstehende Apparatur. Hier ist die Luftportion (1/2) durch Verwendung eines kleinen Quarzröhrchens minimiert, so dass man durchaus mit der rauschenden Flamme erhitzen darf. Auch die zurücksteigende Sperrflüssigkeit (3) ist begrenzt auf das Volumen, das in der Wasserfalle (B) problemlos aufgenommen werden kann.
|
Diese Apparatur ist sicher, auch wenn versehentlich und unbeobachtet der Gasbrenner unter dem Quarzrohr verschoben wird. Die Apparatur wird dann auch so zum Glühen von Marmor verwendet.
»Zwischen Reaktionsräume mit stark unterschiedlichen Reaktionsbedingungen gehört ein Puffervolumen, das groß genug sein muss, um das Berühren der getrennten Stoffe zu verhindern.«
|
| |
 |
2.2. Methode »Masse bestimmen «  am Beispiel von Feststoffen (regelmäßig und unregelmäßig geformt), Flüssigkeiten am Beispiel von Feststoffen (regelmäßig und unregelmäßig geformt), Flüssigkeiten
Die Grundlagen des Wiegens werden an Feststoffen erlernt.
Der Nachweis, dass Luft eine Masse hat, gelingt überraschenderweise nicht mit einem einfachen Wiegen eines mit Luft gefüllten Kolbenprobers!
Man wiegt zunächst einen Kolbenprober mit eingedrückten Kolben auf einer Waage mit 1/100g Einteilung, notiert das Gewicht und füllt den Kolbenprober anschließend mit Luft. Wiegt man nun den mit Luft gefüllten Kolbenprober wieder, so zeigt die Wage das unveränderte Gewicht an. Ursache hierfür ist der Auftrieb in der Luft, der genau so groß ist wie das Gewicht der Luft.


|
Die Bestimmung der Masse ist daher etwas schwieriger, da Luft scheinbar nichts wiegt. So jedenfalls spürt man auch kein Gewicht auf einer ausgestreckten Hand, auf der die gesamte Luftsäule der Erde ruht.
Es gelingt jedoch, wenn man einen der Kolbenprober mit einem Dreiwegehahn verschließt. Dann wird der Kolben mit viel Kraftaufwand bis auf 60mL herausgezogen und mit einem Nagel vor dem Zurückschnellen blockiert. Nun wiegt man den leeren Kolben und notiert die angezeigte Masse. (Im nebenstehenden Bild mit drei Kolbenprobern ausgeführt, weil die Waage nur eine Auflösung von 1/10g besitzt). Jetzt lässt man Luft in die evakuierten Kolbenprober strömen und bestimmt die Masse erneut. Es ergibt sich für 60 mL Luft eine Massenzunahme für Luft bei Raumtemperatur von ca. 0,07 g.
Die Masse von Luft von 60 mL Luft ist schnell bestimmt, viel mehr Zeit benötigen Schülerinnen und Schüler bei dem gleichzeitigen Kentnissstand im Mathematik laut Lehrplan die Dichte von Luft in Gramm pro Liter umzurechnen! |
So kann man die Masse verschiedener Gase (Luft ca. 0,07g/60mL, Kohlenstoffdioxid: ca. 0,11g/60mL, Erdgas: ca.0,04g/60mL) im Anfangsunterricht in Schülerübungen zeigen. Schwieriger als das Experiment ist allerdings für Schülerinnen und Schüler die Umrechnung der Masse auf 1 Liter Gas.
|
|
|
 |
2.3 Die Methode »Temperatur bestimmen« 
Um die Wärme eines Stoffes bestimmen zu kommen, braucht man neben der Masse und der spezifischen Wärme seine Temperatur. (Von der spezifischen Wärme wird hier abgesehen, da das Thema in der Physik erst zu einem späteren Zeitpunkt, wenn überhaupt, bearbeitet wird.)
Um die Temperatur messen zu können, muss man wissen, dass sich alle Stoffe beim Erwärmen ausdehnen (von Anomalien wird hier wiederum abgesehen).
|
|
 |
3. Kalkkreislauf
Naturstoffe oder auch natürliche Stoffe sind Stoffe, die in den natürlichen Gleichgewichten der Erde vorkommen. Sie sind selten chemisch rein, in der Regel liegen sie als Gemische in der Natur in natürlichen Gleichgewichten vor.
Durch Veränderung des Energiegehaltes eines Gleichgewichts entstehen neue angeregte Gleichgewichte. In angeregten Gleichgewichten liegen die Stoffe entweder in anderer Konzentration (Verteilung) vor, oder sie stehen unter verändertem Druck / Temperatur. Diese Gleichgewichtsveränderungen fallen in das Arbeitsgebiet der »Physik«. Wenn dabei aber neue Stoffe mit anderen Eigenschaften entstehen, sind diese Gleichgewichtsveränderungen Forschungsgegenstände der »Chemie«. Die Anpassung des Menschen an die Natur und die natürlichen Gleichgewichte verlangt, dass man Chemikalien und angeregte Zustände, die sich nicht im natürlichen Gleichgewicht mit ihrer Umgebung befinden, nicht in die Natur freisetzt.
Um Schülerinnen und Schülern den Unterschied zwischen einem (Natur-)Stoff im allgemeinen und einer Chemikalie zu verdeutlichen, eignen sich die verschiedenen Kalkkreislauf in der Natur und Technik.
Man beginnt mit der thermischen Zersetzung von grobkristallinen Marmor in einem offen Glühschälchen mit dem Gebläsebrenner. Dabei entsteht ein weißes Pulver. Weitere Veränderungen kann man dabei nicht beobachten, insbesondere nicht die Neueinstellung eines stofflichen Gleichgewichtes. Das verlangt die Abtrennung des Marmors von der restlichen Umwelt durch eine "Apparatur".
Durch einfache Experimente wie das Kalkbrennen in einer halb-offenen Apparatur erhält man die Chemikalien "Kohlensäure" und "Kalklauge". Mit Bromthymolblau (BTB) lassen sich die Säure-Laugen-Eigenschaften der Stoffe nachweisen.
Chemikalien dürfen nicht in die Umwelt gelangen. Daher "neutralisiert" man diese gegenseitig zu Kalk und Wasser. Das gelingt nicht ganz, weil etwas Kohlendioxid aus der halb-offenen Apparatur in die Raumluft entwichen ist.
|
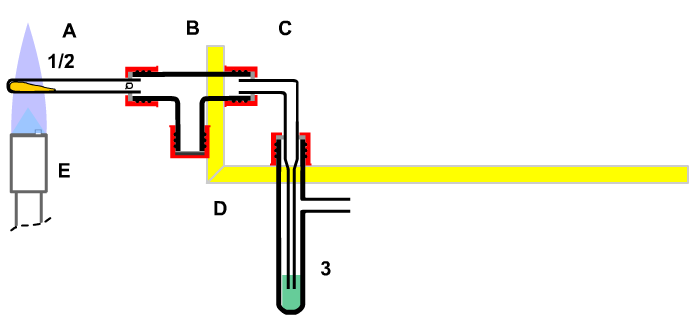 |
Baugruppen:
(A) Glührohr
(B) Wasserfalle
(C) Gaswaschflasche
(D) Halterung
(E) Gasbrenner
Stoffe:
1/2 Feststoff / Luft
3 Sperrflüssigkeit (mit BTB) angefärbtes Wasser |
| Bild 3.1 : Glühapparatur für Marmor |
BTB Indikator Bromthymolblau |
|
|
Niemand hat davon etwas bemerkt.
Man kann die Natur nur Unterschieden erkennen.
Deshalb sollte man Kohlendioxid in der Raumluft nachweisen können. Das gelingt bei einem Atemzug (Ein- und Ausatmen) mit der Apparatur Bild 3.2. |
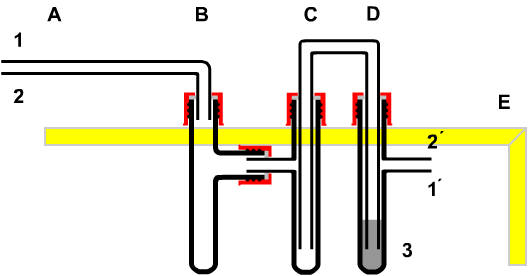 |
Baugruppen:
(A) Mundstück
(B) Wasserfalle
(C) Sicherheitswaschflasche
(D) Gaswaschflasche
(E) Befestigung
Stoffe:
1/2 50 mg Bariumnitrat
3 ca. 3 mL Stickstoffdioxid-Gas
4/5 ca. 3 mL Harnstoff-Lösung; c= 2mol/L
6 Restgas ("Luft") |
| Bild 3.2 : Apparatur zur Untersuchung eines Atemzuges |
BTB Indikator Bromthymolblau |
|
|
Obwohl in dem Raum viele Schüler atmen, scheint die Raumluft kein Kohlenstoffdioxid zu enthalten, wohl aber die ausgeatmete Luft des Einzelnen. Führt man unter verstärkten Sicherheitsnahmen (Ansaugen mittels Pumpe oder Kolbenprober) die Prüfung der Raumluft mit Bariumhydroxid-Lösung durch, so erhält man sehr wohl einen Niederschlag. Die chemischen Nachweise von Kohlenstoffdioxid mit Kalk- oder Barytwasser besitzen also unterschiedliche »Grenzkonzentrationen« »Erfassungsgrenzen«. Diese beiden Begriffe werden im Anfangsunterricht nicht definiert. Zur Definition siehe Grenzkonzentration und Erfassungsgrenze und Erfassungsgrenze 
Man hat das austretende "giftige" Gas Kohlenstoffdioxid nicht bemerkt, weil es immer in unserer Atemluft vorhanden ist. Die Anpassung des Menschen an die "natürliche Umgebung", Umwelt bewirkt, dass wir nur gefährliche Gase, die giftig sind oder in ungewöhnlicher Konzentration vorkommen, bemerken. Wir riechen nur giftige Gase, keinen Sauerstoff, keinen Stickstoff, kein Kohlenstoffdioxid unter 5%, keine Edelgase, keinen Wasserdampf, wohl aber Stickoxide, Halogene, Schwefeloxide, Schwefelwasserstoff, Arsenwasserstoff etc. Die Regel scheint eine Ausnahme zu besitzen: Kohlenstoffmonooxid CO. Aber Kohlenstoffmonooxid kommt ebenso wie die gasförmigen Alkane wie Methan und Ethan nicht frei im natürlichen Gleichgewicht der Luft vor.
Um zu verhindern, dass "giftige" Gase bei Experimenten frei werden, ist also eine vollständig-geschlossene Apparatur zu fordern. Mit einer solchen ist auch die thermische Zersetzung von Schwermetallnitraten möglich. |
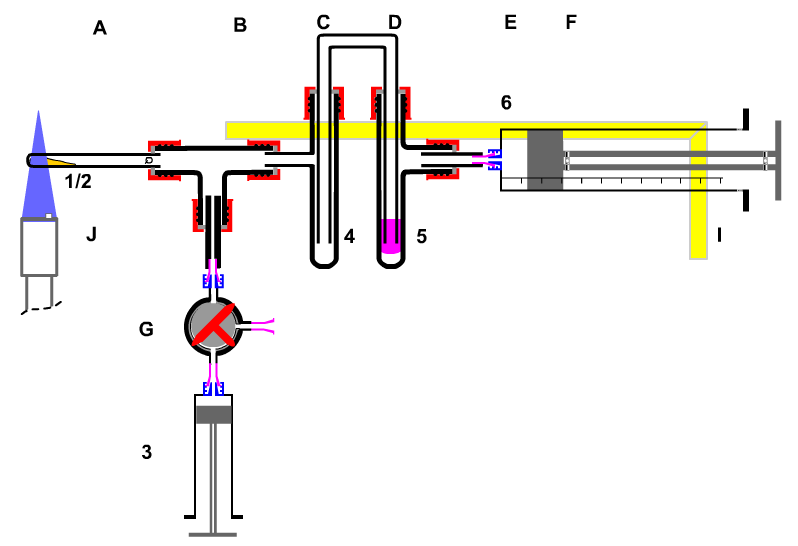 |
Baugruppen:
A Quarz-Glührohr
B T-Stück
C Sicherheitswaschflasche
D Gaswaschflasche
E Luer- Kupplung
F Kunststoff- Kolbenprober 50 mL
G Luer- Kupplung
H Kunststoff- Dreiwegehahn
I Kunststoff- Kolbenprober 10 mL
J Gasbrenner Stoffe:
1/2 50 mg Bariumnitrat
3 ca. 3 mL Stickstoffdioxid-Gas
4/5 ca. 3 mL Harnstoff-Lösung; c= 2mol/L
6 Restgas ("Luft") |
| Bild 3.3 : Apparatur zur Darstellung, Untersuchung und Entsorgung von Stickoxiden |
BTB Indikator Bromthymolblau |
|
|
Diese Apparatur wird im fortgeschrittenen Chemieunterricht eingesetzt und enthält deutlich sichtbar einen Teil der Apparatur des Kalkbrennens, eine Entsorgungseinheit des Atemversuches, um die Stickoxide zu entsorgen und zwischen der Darstellung und der Entsorgung eine "Produktionseinheit" , die hier Erkenntnisse zum chemischen Gleichgewicht "Prinzip des kleinsten Zwanges" produziert wird. Genauso müssen Chemieunternehmen aufgebaut sein. Alle gefährlichen Stoffe sollten am gleichen Ort hergestellt und weiterverarbeitet werden bis mäßig reaktive Stoffe produziert als Halbzeug in den Handel kommen. Alle während der Produktion anfallenden, gefährlichen Stoffe müssen am gleichen Ort in ein natürliches Gleichgewicht entsorgt werden.
Hieran schließen sich Versuche der technischen Chemie an, wie das Kalkbrennen, Kalk löschen, Mörtelherstellung (Kalksandsteinproduktion). Der Mensch bildet also mit Kalkmörtel, Kalkstein und Kalksandstein natürliche Erdhöhlen nach, wie sie seit Urzeiten vom Menschen als Behausung genutzt worden waren.
 |
Ebenso kann man "Behausungen" von Muscheln oder Schnecken sehen und auf Kalk untersuchen.
Auch Brausepulver, Kesselstein oder Kalk von Wasserhähnen können untersucht werden, ebenso wie das Entkalken von Gegenständen im Haushalt mit Essigsäure, Zitronensäure oder Amidosulfonsäure.
Außerdem ist der natürliche Kalkkreislauf bei der Bildung von Tropfsteinhöhlen und kalkhaltigem Wasser Gegenstand des weiteren Unterrichts. |
| Bild 3.4 : Apparatur zur Untersuchung von Feststoffen auf Carbonat |
|
|
|
 |
4. Kohlenstoffdioxid/Kohlensäure Gleichgewicht
  http://www.didaktik.chemie.uni-rostock.de/uploads/media/V_Einfluss__Druck_auf_das_GGW_der_Kohlensaeure.pdf http://www.didaktik.chemie.uni-rostock.de/uploads/media/V_Einfluss__Druck_auf_das_GGW_der_Kohlensaeure.pdf
(wird später ausgeführt)
|
|
 |
5. Carbonsäureester
 exp_anhydrid_alkanol_ester.htm exp_anhydrid_alkanol_ester.htm
(wird später ausgeführt)
|
|
 |
6. Stickstoffdioxid/di-Stickstofftetraoxid Gleichgewicht
(wird später ausgeführt)
Materialien:
Stickstoff 
Lehrerübung Thermische Zersetzung von Bariumnitrat und das Gleichgewicht 2 NO2/N2O4  ; Schülerübung Experiment ; Schülerübung Experiment  |
|
 |
7. Springbrunnen
(wird später ausgeführt) Materialien:
 Ammoniak-Springbrunnen Ammoniak-Springbrunnen
 HMTC-Experiment HMTC-Experiment
 Lernkartei106_C_ammoniak-springbrunnen.doc Lernkartei106_C_ammoniak-springbrunnen.doc
 Salzsäure-Springbrunnen Salzsäure-Springbrunnen
 Lernkartei107_C_ammoniak-springbrunnen.doc Lernkartei107_C_ammoniak-springbrunnen.doc
 Apparativer Vergleich von Salzsäure- und Ammoniak-Springbrunnen Apparativer Vergleich von Salzsäure- und Ammoniak-Springbrunnen
 Umgang mit Stoffen/Chemikalien Umgang mit Stoffen/Chemikalien
 Lernkartei32_C_umgang_chemikalien.doc Lernkartei32_C_umgang_chemikalien.doc
 Lernkartei33_C_stoffe-chemikalien.doc Lernkartei33_C_stoffe-chemikalien.doc
|
|











